Continue sua leitura
Terapia inovadora aprovada para o tratamento do câncer de mama triplo-negativo avançado nos EUA
Usualmente associado a prognóstico menos favorável e com opções terapêuticas limitadas no cenário metastático, o tratamento do câncer de mama triplo-negativo recebeu aprovação de uma terapia inovadora pelo FDA (Food and Drug Administration) no dia 22 de abril. A agência norte-americana concedeu aprovação acelerada para o uso do anticorpo conjugado a droga anti-Trop2 sacituzumab govitecan-hziy para o tratamento de pacientes com câncer de mama triplo-negativo avançado com exposição prévia a pelo menos duas linhas de tratamento sistêmico. Trop2 é uma glicoproteína transmembrana superexpressa em diversos tumores epiteliais, e o tratamento com sacituzumab govitecan-hziy resulta na internalização do componente citotóxico da droga, SN-38, um metabólito de irinotecano com ação de inibição potente da topoisomerase I.
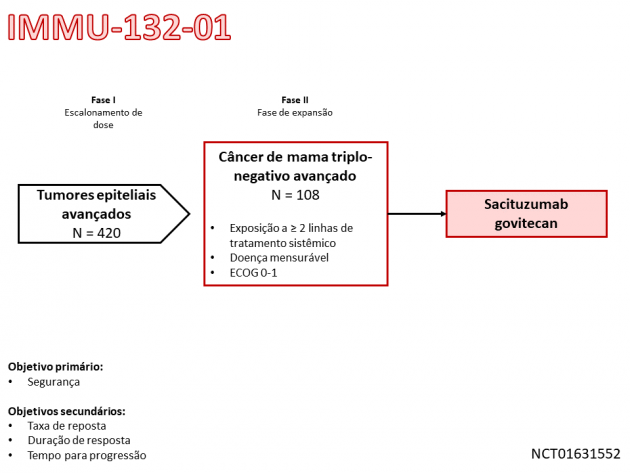
A aprovação baseia-se nos resultados do estudo clínico de fase II IMMU-132-01, que avaliou o tratamento com sacituzumab govitecan-hziy em pacientes com tumores epiteliais de diferentes sítios primários, dentre os quais estavam incluídas 108 pacientes com câncer de mama triplo-negativo avançado. Como resultados, 33,3% das pacientes tratadas apresentaram resposta ao tratamento, com duração mediana do benefício de 7,7 meses em análise pelo comitê revisor independente. A sobrevida livre de progressão mediana foi de 5,5 meses e a sobrevida global mediana de 13,0 meses. Na análise de segurança, 85% das pacientes apresentaram eventos adversos graus maior ou igual a 3. Os eventos adversos mais frequentes em qualquer grau foram náuseas, diarreia, fadiga, neutropenia e anemia. Destacam-se as taxas de eventos adversos hematológicos, com 42% e 11% das pacientes apresentando neutropenia e anemia de graus ≥ 3, respectivamente, e neutropenia febril de qualquer grau ocorreu em 9% das pacientes.
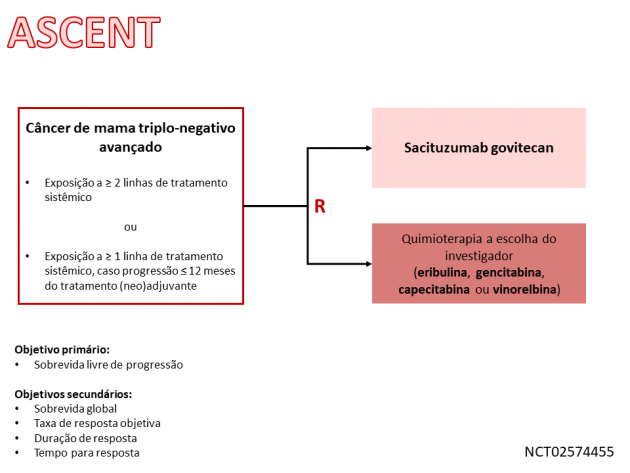
Como acontece em casos de uma aprovação acelerada pela agência norte-americana, um estudo de fase III (ASCENT) foi desenvolvido comparando sacituzumab govitecan-hziy à escolha do investigador no tratamento de pacientes com doença triplo-negativa metastática, cujos resultados serão utilizados para a validação da possível aprovação definitiva. De acordo com um press release da farmacêutica Immunomedics no dia 6 de abril, o estudo foi precocemente suspenso após demonstrar benefício em diferentes endpoints em análise do comitê independente de monitoramento de dados. Os resultados devem ser reportados em futuro próximo.
“Esta nova molécula, uma verdadeira terapia-alvo, representa um grande avanço no tratamento de pacientes com câncer de mama triplo-negativo metastático, e provavelmente será aprovada para outros tipos de câncer de mama assim como outros tipos cânceres”, afirma Dr. Buzaid, Diretor Médico Geral do Centro de Oncologia da BP – A Beneficência Portuguesa de São Paulo e Membro do Comitê Gestor do Centro de Oncologia do Hospital Israelita Albert Einstein.
Por Dr. Daniel Vargas P. de Almeida
