Continue sua leitura
Pembrolizumabe aprovado pela ANVISA para o tratamento do câncer de mama inicial
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 23 de maio de 2022 o uso de pembrolizumabe para tratamento de câncer de mama triplo-negativo (TN) localizado considerado de risco alto, em combinação à quimioterapia neoadjuvante. Na aprovação, pembrolizumabe é mantido como monoterapia adjuvante após a cirurgia.
Esta nova indicação terapêutica no cenário da doença localizada é embasada no estudo de fase III KEYNOTE-522, que randomizou 1.174 pacientes com câncer de mama localizado de risco alto para receber pembrolizumabe ou placebo associados a quimioterapia (carboplatina + paclitaxel seguido por doxorrubicina ou epirrubicina combinadas a ciclofosfamida). Foram caracterizadas elegíveis para o estudo pacientes com tamanho da lesão primária entre 1 e 2 cm com comprometimento linfonodal, ou tamanho > 2 cm independente do status linfonodal. Os objetivos coprimários do estudo foram a taxa de resposta patológica completa (ypT0/Tis ypN0) e sobrevida livre de eventos.
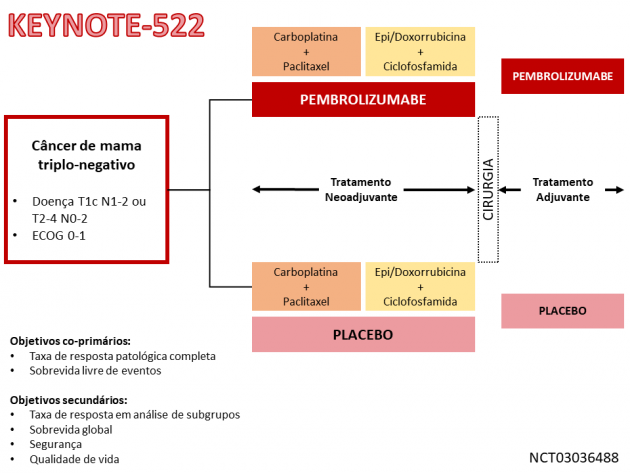
Os dados iniciais do estudo foram publicados no periódico New England Journal of Medicine em 2020, e uma atualização dos resultados foi posteriormente publicada no mesmo jornal em 2022. A taxa de resposta completa foi de 63% no braço pembrolizumabe e 56% no braço placebo (p<0,001), e o benefício foi consistente entre os diferentes subgrupos analisados, incluindo os subgrupos estratificados de acordo com a expressão de PDL-1. Adicionalmente, o tratamento com pembrolizumabe reduziu em 37% o risco de eventos (HR=0,63; IC de 95%: 0,48-0,82; p<0,001), desfecho que inclui progressão de doença, recidiva local ou à distância, segundo tumor primário ou morte por qualquer causa. Houve também uma tendência a benefício em sobrevida global em favor do braço pembrolizumabe (HR=0,72; IC de 95%: 0,51-1,02). Na avaliação de segurança, a taxa de eventos adversos relacionadas ao tratamento de graus ≥ 3 foi de 77,1% no braço pembrolizumabe e 73,3% no braço placebo, e a taxa de eventos adversos imuno-mediados foi de 33,5% e 11,3% nos mesmos braços, respectivamente.
A dose de tratamento recomendada é pembrolizumabe 200 mg, via intravenosa, a cada 3 semanas, administrado de maneira neoadjuvante por 24 semanas e depois mantido como monoterapia adjuvante por até 27 semanas.
Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, enfatiza: “os dados de sobrevida livre de eventos do estudo KEYNOTE-522 são bastante encorajadores, e mostram que a combinação estudada oferece às mulheres com câncer de mama TN em estágio inicial de risco alto uma nova opção de tratamento. Os resultados desse estudo são tão substanciais, que motivaram uma rápida atualização da diretriz da ASCO a respeito do manejo de tratamento neoadjuvante em câncer de mama TN localizado de risco alto, adicionando a recomendação sobre o uso de pembrolizumabe nesse contexto. Trata-se de uma aprovação histórica, trazendo pela primeira vez imunoterapia ao tratamento de câncer de mama localizado”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
