Continue sua leitura
Novo anticorpo aprovado para o tratamento do câncer de mama HER-2 positivo avançado nos EUA
O FDA (Food and Drug Administration) aprovou em 16 de dezembro de 2020 o anticorpo monoclonal anti-HER-2 margetuximabe para o tratamento de pacientes com câncer de mama HER-2 positivo avançado previamente expostas a dois ou mais regimes de tratamento sistêmico anti-HER-2, um deles necessariamente administrado no cenário de doença metastática.
A aprovação é baseada nos resultados do estudo de fase III SOPHIA, que randomizou 536 pacientes com câncer de mama HER-2 positivo metastático previamente expostas a tratamento sistêmico com terapias anti-HER-2 entre quimioterapia à escolha do investigador (capecitabina, eribulina, gencitabina ou vinorelbina) combinada a margetuximabe ou a trastuzumabe. O braço que recebeu margetuximabe apresentou redução de 24% no risco de progressão de doença ou morte quando comparado ao braço de trastuzumabe (HR=0,76; IC de 95%: 0,59-0,98; p=0,033), um dos objetivos coprimários do estudo, com medianas de 5,8 versus 4,9 meses, respectivamente.
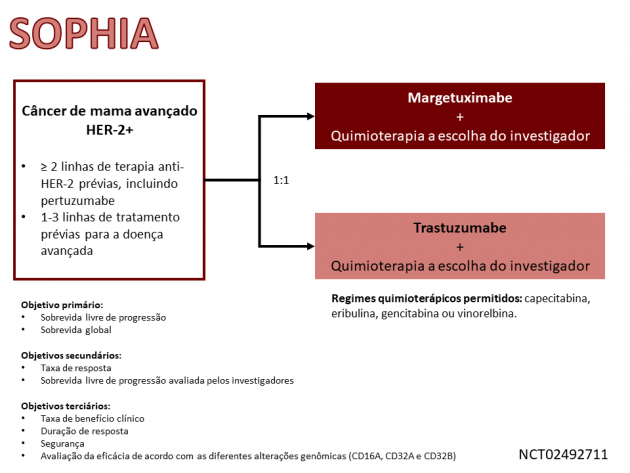
Resultados preliminares de sobrevida global, outro objetivo coprimário do estudo, foram apresentados após análise interina dos dados no congresso de San Antonio 2019, contemplando um seguimento mediano de 15,6 meses. A sobrevida global mediana foi de 21,6 versus 19,8 meses para os braços margetuximabe e trastuzumabe, respectivamente (HR=0,89; IC de 95%: 0,69-1,13; p=0,326). A taxa de resposta objetiva ao regime com margetuximabe foi de 22%, enquanto o mesmo desfecho foi apresentado em 16% das pacientes do braço de trastuzumabe, sendo a duração mediana do benefício de 6,1 e 6,0 meses nos mesmos grupos, respectivamente. A taxa de eventos adversos de graus maior ou igual a 3 foi de 52% no braço margetuximabe, destacando-se fadiga, náuseas, diarreia e vômito como os eventos de maior incidência.
A dose de tratamento recomendada é margetuximabe 15 mg/kg, via intravenosa, a cada 3 semanas. Atenção especial deve ser dada ao risco de infusões reacionais, evento adverso apresentado por 13% da população estudada, sendo que 1,5% deles foram apresentados em grau 3.
Como destaca a Dra. Juliana Martins Pimenta, oncologista clínica da BP – A Beneficência Portuguesa de São Paulo, “grandes avanços no tratamento do câncer de mama metastático HER-2 positivo foram obtidos recentemente com a aprovação de medicações como trastuzumabe deruxtecano e tucatinibe e aprovação atual do margetuximabe pelo FDA”.
Entretanto, a Dra. Juliana ressalta: “diante dos resultados tão expressivos de eficácia em pacientes extensamente politratadas com o uso das duas primeiras medicações, o trastuzumabe deruxtecano com sua altíssima taxa de resposta (acima de 60%) e sobrevida livre de progressão de 19 meses de acordo com os dados atualizados no congresso de San Antonio 2020, e o tucatinibe com seus resultados animadores para pacientes com metástases em sistema nervoso central, provavelmente a opção de uso do margetuximabe será considerada em linhas mais tardias, visto os seus resultados mais modestos de eficácia. Aguardamos aprovação em breve no Brasil do trastuzumabe deruxtecano e tucatinibe pela ANVISA”.
Por Dr. Daniel Vargas P. de Almeida
