Continue sua leitura
Neratinibe como uma opção para o tratamento adjuvante do câncer de mama HER-2 positivo
O inibidor de tirosina quinase de ERBB neratinibe representa uma opção de tratamento adjuvante estendido no Brasil em pacientes com câncer de mama HER-2 positivo previamente tratadas com trastuzumabe adjuvante. A droga recebeu a aprovação da ANVISA (Agência Nacional de Vigilância Sanitária) em dezembro de 2021 e a aprovação do preço da droga pela CMED (Câmara de Regulação do Mercado de Medicamentos) ocorreu em fevereiro de 2022.
A Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, comenta: “É importante ressaltar que o estudo ExteNET foi desenhado e conduzido em um período em que não havia disponibilidade para uso de pertuzumabe ou T-DM1 em contexto de doença localizada e, portanto, não conhecemos o impacto nos desfechos de sobrevida do uso um ano adicional de neratinibe após 1 ano de terapia anti-HER-2 em paciente que recebe pertuzumabe ou T-DM1 na doença localizada”.
Os dados que embasaram a aprovação resultam do estudo de fase III ExteNET, que randomizou 2.840 pacientes com câncer de mama HER-2 positivo com comprometimento linfonodal ou submetidas a terapia neoadjuvante e com ausência de resposta completa patológica entre neratinibe ou placebo administrados por 1 ano após conclusão de tratamento adjuvante com trastuzumabe em até 1 ano previamente à randomização. Dentre a população avaliada, aproximadamente metade das pacientes encontravam-se em status pré-menopausa, cerca de 75% apresentavam comprometimento linfonodal (incluindo 30% com ≥ 4 linfonodos positivos), 57% possuíam receptores hormonais positivos e 68% haviam recebido regime quimioterápico com antraciclína e taxano.
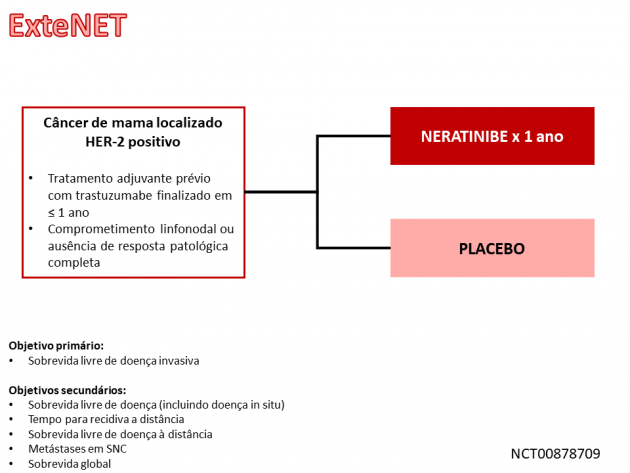
O objetivo primário do estudo foi a sobrevida livre de doença invasiva (IDFS), no qual o uso de neratinibe reduziu em 27% o risco de atingir o desfecho quando comparado a placebo (HR=0,73; IC de 95%: 0,57-0,92; p=0,0083). A sobrevida livre de doença (incluindo recidiva de carcinoma ductal in situ) também favoreceu o braço de neratinibe (HR=0,71; IC de 95%: 0,56-0,89; p=0,0035). No subgrupo com coexpressão de receptor hormonal, o benefício absoluto em IDFS em 5 anos foi de 5,1% nas pacientes que iniciaram o inibidor de tirosina quinase com até 1 ano após término do trastuzumabe adjuvante.
Na avaliação de segurança, os principais eventos adversos de graus ≥ 3 ocorridos no braço neratinibe foram diarreia, vômito e náuseas.
“Algumas análises de subgrupos foram previamente apresentadas, destacando-se o grupo de pacientes com coexpressão de receptor hormonal (RH) que não experimentam resposta patológica completa após poliquimioterapia e trastuzumabe neoadjuvantes. Nessa subpopulação, o benefício absoluto em IDFS com uso de neratinibe foi de 7,4% em 5 anos (HR=0,60; IC de 95%: 0,33-1,07) e 9,1% em sobrevida global em 8 anos (HR=0,47; IC de 95%: 0,23-0,92). Os pesquisadores também analisaram dados de pacientes diagnosticadas com doença secundária em sistema nervoso central (SNC). Entre as pacientes com doença RH positiva que iniciaram o tratamento com neratinibe dentro de um ano após término de trastuzumabe adjuvante, neratinibe foi associado a um número menor de eventos no SNC em todos os grupos estudados. Ressalto que a medicação possui diarreia como grande marco de sua toxicidade, sendo necessário escalonamento paulatino da dose da medicação e uso adjuvante de medicações profiláticas. No estudo CONTROL, as pacientes poderiam escalonar a dose de neratinibe da seguinte forma: dose diária de 120 mg na semana 1, seguida de dose diária de 160 mg na semana 2, seguida de uma dose diária de 240 mg na semana 3 em diante. Tal intervenção, em combinação com medicações profiláticas como a loperamida, resultou em redução de mais de 60% na quantidade de pacientes que apresentaram diarreia grau 3, quando comparado às pacientes incluídas no estudo exteNET. Tal estratégia é, inclusive, contemplada em recomendação formal do FDA (Food and Drug Administration)”, complementa Dra. Debora Gagliato.
Por Dr. Daniel Vargas P. de Almeida
