Continue sua leitura
Imunoterapia recebe aprovação do FDA para tratamento do câncer de colo uterino localizado
Em 12 de janeiro de 2024, o FDA (Food and Drug Administration) aprovou o uso de pembrolizumabe combinado com quimiorradioterapia (QT/RT), para o tratamento de pacientes com câncer cervical de estágio III-IVA segundo a classificação FIGO de 2014.
A avaliação de pembrolizumabe neste cenário foi conduzida no estudo KEYNOTE-A18, que incluiu 1.060 pacientes com câncer cervical sem cirurgia definitiva prévia, radioterapia ou terapia sistêmica. Foram incluídas 596 pacientes com doença de estádio III-IVA segundo a FIGO 2014 e 462 pacientes com doença de estádio IB2-IIB, com linfonodos positivos. As pacientes foram randomizadas (1:1) para receber pembrolizumabe ou placebo por 5 ciclos + QT/RT, seguido de pembrolizumabe ou placebo por 15 ciclos. O regime de QT/RT incluiu cisplatina semanalmente por 5 ciclos e radioterapia externa (EBRT), seguida por braquiterapia. Entre as 596 pacientes com doença de estágio III-IVA, a idade mediana foi 52 anos (intervalo: 22 a 87 anos), 17% possuíam ≥ 65 anos, 93% possuíam tumores com expressão de PD-L1 por CPS ≥ 1, 70% tinham linfonodos pélvicos e/ou para-aórticos positivos, 83% possuíam doença de histologia escamosa, 85% receberam EBRT IMRT ou VMAT, e a dose mediana EQD2 foi de 87 Gy.
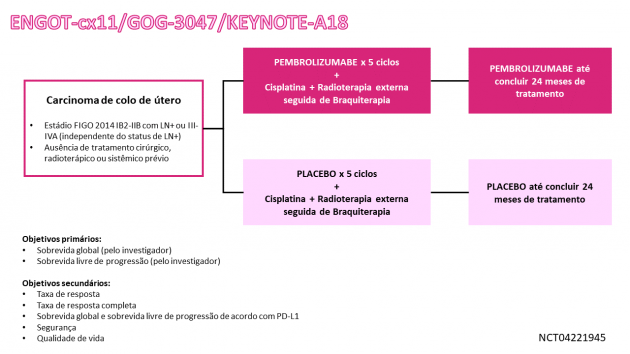
O estudo demonstrou benefício estatisticamente significativo na sobrevida livre de progressão (SLP) na população geral. Em uma análise exploratória de subgrupo das 596 pacientes com doença de estádio III-IVA, o HR (hazard ratio) para SLP foi de 0,59 (IC de 95%: 0,43-0,82), com taxa de SLP aos 12 meses de 81% nas pacientes no braço pembrolizumabe comparado a 70% no braço placebo. Em contraste, na análise de subgrupo exploratória das 462 pacientes com doença de estádio IB2-IIB, o HR para SLP foi de 0,91 (IC de 95%: 0,63-1,31), indicando que o impacto na SLP na população geral foi principalmente atribuída a pacientes com doença de estádio III-IVA. Os dados de sobrevida global ainda são imaturos. Nas avaliações de segurança, os eventos adversos mais comuns (≥ 10%) ocorrendo em pacientes que receberam pembrolizumabe com QT/RT incluíram: náuseas, diarreia, vômito, infecção do trato urinário, fadiga, hipotireoidismo, constipação, diminuição do apetite, perda de peso, dor abdominal, febre, hipertireoidismo, disúria, erupção cutânea e dor pélvica.
A dosagem recomendada para pembrolizumabe nesta indicação é de 200 mg, via intravenosa, a cada 3 semanas ou 400 mg, via intravenosa, a cada 6 semanas até progressão de doença, toxicidade limitante ou a conclusão de tratamento por 24 meses. Quando os dias de tratamento coincidirem, pembrolizumabe deve ser administrado antes da QT/RT.
Esta aprovação foi conduzida sob o Projeto Orbis, uma iniciativa do Centro de Excelência em Oncologia do FDA. Para esta revisão, o FDA colaborou com a Therapeutic Goods Administration (TGA) da Austrália e a Agência Nacional de Vigilância Sanitária (ANVISA) do Brasil. A análise dos dados está em andamento nas demais agências reguladoras.
Por Dr. Daniel Vargas P. de Almeida
