Continue sua leitura
Imunoterapia aprovada no tratamento de primeira linha do câncer de colo uterino pelo FDA
O FDA (Food and Drug Administration) aprovou, em 13 de outubro de 2021, o imunoterápico pembrolizumabe em combinação à quimioterapia associados ou não a bevacizumabe para o tratamento do câncer de colo uterino persistente, recidivado ou metastático com expressão de PDL-1 ≥ 1 através do escore combinado positivo (CPS).
Adicionalmente, a agência também modificou para aprovação definitiva o uso de pembrolizumabe em monoterapia no tratamento de pacientes com câncer de colo uterino metastático com CPS ≥ 1 previamente expostos a pelo menos uma linha de quimioterapia. Esta indicação terapêutica na segunda linha possuía aprovação acelerada pelo FDA desde junho de 2018.
A avaliação de eficácia e segurança da combinação de pembrolizumabe à quimioterapia no tratamento de primeira linha que motivou a nova aprovação foi realizada no estudo de fase III KEYNOTE-826. Nele, 617 pacientes com doença persistente, recidivada ou metastática sem tratamento sistêmico prévio neste cenário foram randomizadas entre pembrolizumabe ou placebo associados a quimioterapia (paclitaxel com cisplatina ou carboplatina) por até 6 ciclos combinada ou não a bevacizumabe. A população incluída era contemplada em sua maioria por pacientes com doença de histologia escamosa, apenas cerca de 10% das pacientes apresentavam PDL-1 CPS < 1, cerca de 75% dos casos haviam recebido tratamento com radioterapia ou quimioirradiação anteriormente, em torno de 20% dos casos a doença apresentou-se metastática ao diagnóstico e pouco menos de dois terços das pacientes receberam tratamento com bevacizumabe durante o estudo.
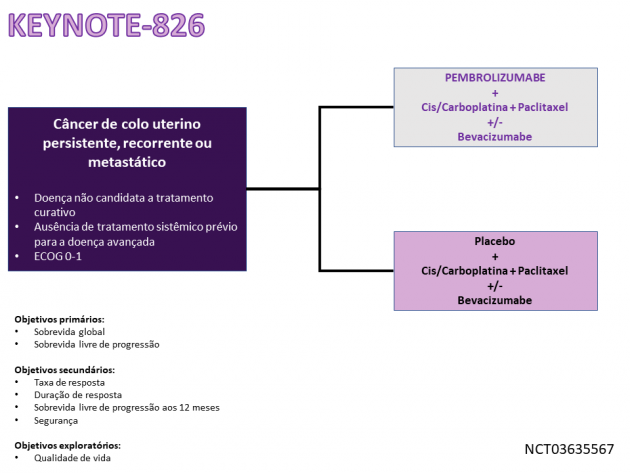
Na população PDL-1 CPS > 1 (n=548), o braço tratado com pembrolizumabe apresentou benefício em sobrevida livre de progressão (medianas de 10,4 versus 8,2 meses; HR=0,62; IC de 95%: 0,50-0,77; p < 0,0001), além de uma redução de 36% no risco de morte (HR=0,64; IC de 95%: 0,50-0,81; p=0,0001) em comparação a placebo. A taxa de resposta e duração mediana de resposta também foram superiores no braço tratado com o imunoterápico (68% e 18 meses versus 50% e 10,4 meses, respectivamente). A taxa de eventos adversos de graus ≥ 3 relacionados ao tratamento foi de 68,4% versus 64,1% para pembrolizumabe e placebo, respectivamente, destacando-se como eventos adversos apresentados em maior frequência no braço do anti-PD-1: anemia, alopecia, náuseas, diarreia e fadiga.
O regime de tratamento recomendado é pembrolizumabe 200 mg, via intravenosa, a cada 3 semanas ou 400 mg a cada 6 semanas até progressão de doença, toxicidade limitante ou 24 meses de tratamento.
A Dra. Juliana Martins Pimenta, oncologista da BP – A Beneficência Portuguesa de São Paulo, comenta que “trata-se de uma importante conquista no tratamento do câncer de colo de útero, sendo o primeiro estudo a demonstrar ganho de sobrevida global desde os dados do GOG 240, que levou à aprovação do bevacizumabe no tratamento de primeira linha do câncer de colo de útero metastático”.
“Estes resultados elevam a sobrevida global mediana do câncer de colo de útero metastático dos aproximadamente 17 meses obtidos no GOG 240 para aproximadamente 24 meses, ganho significativo para uma doença típica de países pobres e subdesenvolvidos, carente de terapêuticas eficazes e que acomete tantas mulheres jovens mundo afora. Os resultados do KEYNOTE-826 reforçam a importância do uso de imunoterapia no tratamento do câncer de colo de útero, também demonstrado em outros estudos com esta classe de drogas no cenário após progressão a primeira linha baseada em platina como o KEYNOTE-158 (pembrolizumabe) e o Empower-Cervical 1/GOG-3016/ENGOT-CX9 (cemiplimabe), só que dessa vez levando a recomendação do uso dessa classe de medicação mais precocemente, já na primeira linha da doença metastática. São aguardados resultados de estudos em andamento para avaliar o benefício dessa classe de medicação no tratamento da doença localmente avançada”, complementa a Dra. Juliana Martins Pimenta.
Por Dr. Daniel Vargas P. de Almeida
