Continue sua leitura
Combinação de imunoterapia recebe aprovação regular para tratamento do câncer de endométrio nos EUA
O FDA (Food and Drug Administration) concedeu em 21 de julho de 2021 a aprovação regular ao tratamento de pacientes portadoras de carcinoma de endométrio com ausência de instabilidade de microssatélites (MSI-H) ou deficiência de mismatch repair (dMMR) utilizando a combinação de pembrolizumabe e lenvatinibe após progressão à uma ou mais terapias sistêmicas e na ausência da possibilidade de tratamentos cirúrgicos ou radioterápicos com intuito curativo. O regime já possuía aprovação acelerada concedida pela agência desde 17 de setembro de 2019.
Esta aprovação definitiva foi baseada nos dados do Estudo 309/KEYNOTE-775, que randomizou 827 pacientes com carcinoma de endométrio avançado entre pembrolizumabe e lenvatinibe ou tratamento quimioterápico à escolha do investigador (doxorrubicina ou paclitaxel).
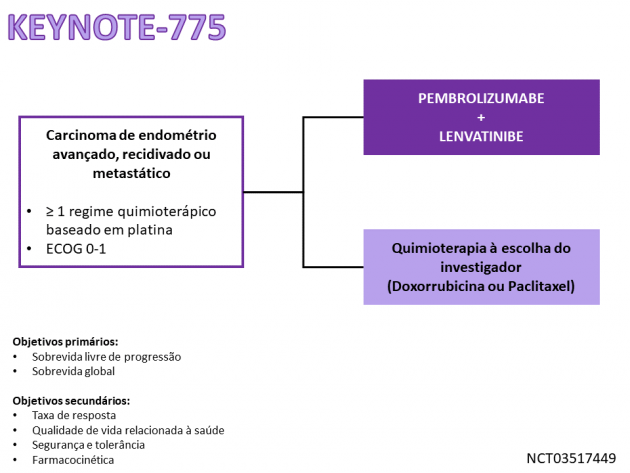
O tratamento com o combo de imunoterapia reduziu em 32% o risco de morte (HR=0,68; IC de 95%: 0,56-0,84; p=0,0001) quando comparado à quimioterapia nas pacientes com ausência de MSI-H/dMMR, com medianas de 17,4 versus 12,0 meses. Adicionalmente, esta população também derivou benefícios em sobrevida livre de progressão (HR=0,60; IC de 95%: 0,50-0,72; p<0,0001), taxa de resposta (30% versus 15%; p<0,0001) e duração de resposta (9,2 versus 5,7 meses).
Os eventos adversos mais comuns com o tratamento foram hipotireoidismo, hipertensão arterial, fadiga, diarreia e alterações musculoesqueléticas.
As doses de tratamento recomendadas são pembrolizumabe, 400 mg, via intravenosa a cada 6 semanas e lenvatinibe, 20 mg, via oral uma vez ao dia.
Por Dr. Daniel Vargas P. de Almeida
