Continue sua leitura
Terapia oral inovadora é aprovada para o tratamento do câncer de rim nos EUA
O FDA (Food and Drug Administration) aprovou em 13 de agosto de 2021 o inibidor do fator induzível por hipóxia 2 alfa (HIF-2α) belzutifan para o tratamento de pacientes portadores de neoplasias associadas com a doença de von Hippel-Lindau (VHL), como o carcinoma de células renais, hemangioblastomas de sistema nervoso central (SNC) e tumores neuroendócrinos pancreáticos (pNET). Trata-se de uma patologia hereditária autossômica dominante, com mais de 1500 diferentes mutações detectadas no gene VHL. Pacientes portadores de doença de VHL possuem um risco estimado em até cerca de 70% de desenvolverem um carcinoma de células renais aos 60 anos.
A aprovação foi baseada nos dados do Estudo 004, ainda em andamento, que avalia o uso de belzutifan no tratamento de 61 pacientes portadores de carcinoma de células renais associado ao VHL. Dentre os critérios de seleção do estudo, foi permitida a inclusão de pacientes com outras neoplasias associadas ao VHL.
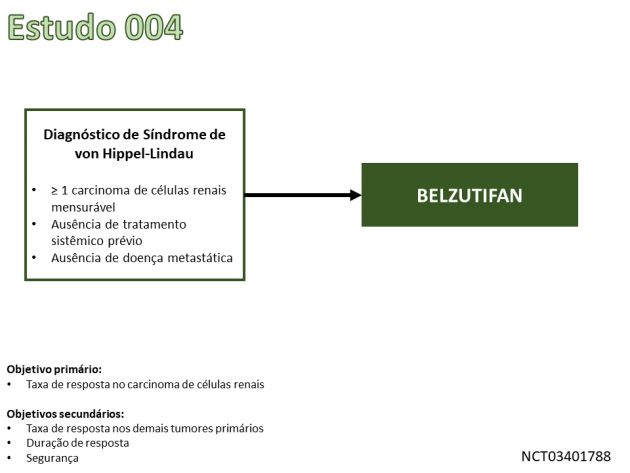
A taxa de resposta a belzutifan nos carcinomas de células renais foi 49%, com duração de resposta ≥ 12 meses em 56% dos pacientes. O tempo para a resposta mediano foi 8 meses. Nos pacientes com outros tumores associados a VHL, a taxa de resposta foi 63% no hemangioblastoma de SNC (n=24) e 83% dentre aqueles com pNET (n=12). A duração de resposta foi ≥ 12 meses em 73% e 50% dos pacientes portadores hemangioblastoma de SNC e pNET, respectivamente. Na avaliação de segurança, os eventos adversos mais frequentes com o uso de belzutifan foram anemia, fadiga, elevação de creatinina sérica, cefaleia, tontura, hiperglicemia e náuseas. Durante o tratamento com belzutifan podem ocorrer anemia e hipóxia graves, sendo que 90% dos pacientes apresentaram algum grau de anemia, com 7% deles apresentando esta toxicidade em grau ≥ 3. Em caso de anemia durante o tratamento, não é recomendado o uso de agentes estimuladores de eritropoiese, e o emprego de hemotransfusões deve ser realizado conforme indicação clínica.
“O belzutifan, também conhecido pelo codinome MK-6482, cujo nome comercial nos EUA será Welireg®, é o primeiro inibidor de HIF-2α do mercado, e recebeu recentemente aprovação pelo FDA para tratamento de pacientes com síndrome de VHL. De fato, de acordo com indicação atual em bula americana, não é recomendado o uso de eritropoietina para o tratamento da anemia secundária ao belzutifan, em decorrência do tratamento concomitante com as drogas não ter sido estudado durante o Estudo 004, além deste estudo ter incluído exclusivamente pacientes com síndrome de VHL e, portanto, com expectativa de vida mais longa. Adicionalmente, é importante lembrar que o uso de eritropoietina já foi associado em outros estudos a um aumento da taxa de progressão de cânceres e a um maior risco de eventos tromboembólicos. Porém, nos demais estudos randomizados que vêm sendo desenvolvidos em pacientes com carcinoma de células renais metastáticas refratários a tratamentos prévios, como por exemplo o estudo MK-6482-005, o uso de eritropoietina vem sendo avaliado para o controle da anemia secundária ao belzutifan”, destaca o Dr. Fabio Schutz, oncologista da BP – A Beneficência Portuguesa de São Paulo.
“O belzutifan é também uma droga bastante promissora no tratamento do carcinoma de células renais tipo células claras metastático refratário, onde já foi estudado em estudo fase I/II e demonstrou taxa de resposta objetiva de 25% em pacientes previamente expostos à múltiplas linhas de tratamento, incluindo imunoterapia com anti-PD-1/PDL-1 e inibidores de tirosina quinase do VEGFR. A depender dos resultados do estudo fase III randomizado MK-6482-005, acredito que o belzutifan possa chegar também em breve para pacientes com carcinoma de células renais tipo células claras metastático, não necessariamente relacionado à síndrome de VHL”, conclui Dr. Fabio Schutz.
Por Dr. Daniel Vargas P. de Almeida
