Continue sua leitura
Nova opção de tratamento para o câncer de próstata não metastático aprovado nos EUA e no Brasil
A agência regulatória norte-americana Food and Drug Administration (FDA) aprovou em 13 de julho de 2018 a utilização do agente anti-hormonal enzalutamida para tratamento dos pacientes com câncer de próstata não metastático resistentes a castração. No território nacional, a Agência Nacional de Vigilância Sanitária (ANVISA) também ampliou as indicações de tratamento com enzalutamida em 30 de julho de 2018, adicionando a mesma indicação de tratamento recentemente aprovada nos Estados Unidos.
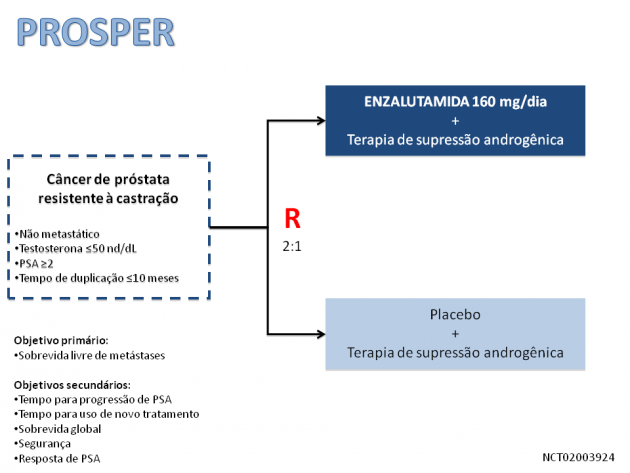
Tais aprovações referem-se a uma nova indicação de tratamento para essa droga e baseiam-se nos resultados do estudo de fase III PROSPER, apresentado na ASCO-GU 2018 e recentemente publicado no New England Journal of Medicine. Trata-se de um estudo multicêntrico que randomizou 1401 pacientes com câncer de próstata resistentes à castração não metastáticos com critérios de alto risco (PSA ≥ 2 ng/ml com tempo de duplicação ≤ 10 meses) para receberem tratamento com enzalutamida ou placebo, mantendo a terapia de supressão androgênica. Após uma mediana de 18,4 meses de tratamento com enzalutamida (11,1 meses com placebo), houve redução de 71% no risco de metástases ou morte com o uso de enzalutamida, com significativo aumento da sobrevida livre de metástases mediana de 14,7 meses para 36,6 meses (HR 0,29, IC de 95% 0,24-0,35, p<0,001). Os dados de sobrevida global ainda são imaturos nessa análise. Em relação aos dados de segurança, as taxas de eventos adversos de graus ≥ 3 foram 31% com enzalutamida versus 23% com placebo, sendo os mais frequentes astenia/fadiga, fogachos, hipertensão, vertigem, náuseas e quedas.
Segundo o Dr. Fabio Schutz, oncologista da BP – A Beneficência Portuguesa de São Paulo, “o tratamento de pacientes com câncer de próstata refratário à castração (CRPC) e sem presença de metástases (nmCRPC) detectáveis pelos métodos de imagens convencionais permanecia, até pouco tempo, como uma necessidade não atendida, devido a ausência de terapias disponíveis. Até então, o uso de enzalutamida e abiraterona era aprovado apenas para pacientes com CRPC e presença de doença metastática (mCRPC) visível. Agora, com esta aprovação pela ANVISA, os pacientes com nmCRPC podem receber tratamento com enzalutamida, e prolongar assim o tempo até o aparecimento da doença metastática. O estudo PROSPER demonstra e solidifica uma questão conceitual extremamente relevante, a importância da contínua e profunda inibição do receptor de androgênio no câncer de próstata mesmo na vigência da testosterona sérica em níveis de castração, e mesmo na presença de doença microscópica ou de muito pequeno volume (ex. nmCRPC). Entretanto, a análise de sobrevida global do estudo PROSPER ainda é imatura e será importante entender se o uso “muito precoce” da enzalutamida, no cenário nmCRPC, é capaz de aumentar a sobrevida global, visto que, via de regra, a maioria dos pacientes com nmCRPC até recentemente receberiam algum dos novos agentes hormonais já aprovados (enzalutamida e abiraterona) quando do desenvolvimento de metástases radiológicas. Isto será importante para se discutir melhor o sequenciamento do tratamento, os custos financeiros e os riscos de eventos adversos relacionados ao uso muito precoce desta droga no cenário nmCRPC”.
Por Dr. Daniel Vargas P. de Almeida
