Continue sua leitura
Aprovada combinação de niraparibe e abiraterona para o tratamento do câncer de próstata resistente à castração metastático nos EUA
Em 11 de agosto de 2023, o FDA (Food and Drug Administration) aprovou a combinação de doses fixas de niraparibe e abiraterona para o tratamento de pacientes com câncer de próstata metastático resistente à castração (CPRCm) com mutação de BRCA patogênica ou possivelmente patogênica.
A eficácia desta combinação foi avaliada na coorte 1 do MAGNITUDE, um estudo clínico randomizado, duplo-cego e controlado por placebo, que incluiu 423 pacientes com CPRCm apresentando mutações nos genes de reparo do DNA. Os pacientes foram randomizados a uma razão 1:1 para receber niraparibe e abiraterona ou placebo e abiraterona, sendo estratificados por exposição prévia a docetaxel, a terapia antiandrogênica, uso prévio de abiraterona e status de BRCA. Dentre os 423 pacientes incluídos, 225 (53%) tinham mutações nos genes BRCA (BRCAm), 24% haviam recebido docetaxel previamente e 5% haviam recebido terapia prévia com agente antiandrogênico para doença metastática sensível à castração ou não metastática resistente à castração.
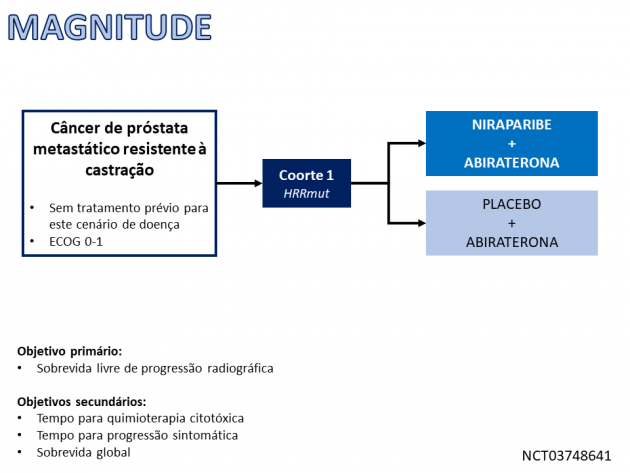
A combinação de niraparibe e abiraterona demonstrou benefício estatisticamente significativo na sobrevida livre de progressão radiográfica (SLPr) em comparação com placebo e abiraterona em pacientes BRCAm, com medianas de 16,6 versus 10,9 meses (HR=0,53; IC de 95%: 0,36-0,79; p=0,0014). Análise exploratória de sobrevida global (SG) nesta população BRCAm demonstrou medianas de 30,4 versus 28,6 meses (HR=0,79; IC de 95%: 0,55-1,12), em favor do braço tratado com a combinação ativa. Apesar da diferença estatística na SLPr observada na população geral da coorte 1 (HR=0,73; IC de 95%: 0,56-0,96; p=0,0217), os resultados dentre os 198 pacientes (47%) sem mutações de BRCA (HR para SLPr=0,99; IC de 95%: 0,67-1,44 e HR para SG=1,13; IC de 95%: 0,77-1,64) sugerem que os dados da população global foram resultantes do subgrupo de pacientes com BRCAm. No tocante à segurança, os eventos adversos mais comuns (≥20%), incluindo anormalidades laboratoriais, foram: anemia, linfopenia, leucopenia, dor musculoesquelética, fadiga, plaquetopenia, elevação de fosfatase alcalina, constipação intestinal, hipertensão arterial, náuseas, neutropenia, elevação de creatinina, hipercalemia e elevação de transaminases. Dentre todos os pacientes tratados com niraparibe e abiraterona (n=423), 27% necessitaram de transfusão sanguínea, incluindo 11% que necessitaram de múltiplas transfusões.
A dose recomendada é de um comprimido, contendo 200 mg de niraparibe e 1.000 mg de abiraterona, tomado por via oral uma vez por dia em combinação com prednisona 10 mg até progressão de doença ou toxicidade limitante.
Por Dr. Daniel Vargas P. de Almeida
