Continue sua leitura
Novo anticorpo anti-HER-2 é aprovado para o tratamento do câncer gástrico avançado nos EUA
O FDA (Food and Drug Administration) aprovou em 15 de janeiro de 2021 o anticorpo conjugado a droga trastuzumabe deruxtecano para pacientes portadores de adenocarcinoma gástrico ou da junção gastro-esofágica (JGE) metastático com expressão positiva de HER-2 previamente expostos a tratamento com um regime contendo trastuzumabe. “Essa é a primeira terapia anti-HER-2 a demonstrar eficácia e ser aprovada por agências regulatórias para o tratamento de adenocarcinoma esôfago-gástrico com hiperexpressão de HER-2 desde a aprovação do trastuzumabe há mais de 10 anos”, ressalta Dr. Lucas V. dos Santos, oncologista clínico da BP – A Beneficência Portuguesa de São Paulo, sobre a aprovação.
A eficácia do tratamento aprovado foi avaliada no estudo de fase II DESTINY-Gastric01, que randomizou a uma razão 2:1 um total de 187 pacientes portadores de adenocarcinoma gástrico ou da JGE metastático com expressão de HER-2 previamente expostos a dois ou mais regimes de tratamento sistêmico, incluindo fluoropirimidina e trastuzumabe, entre receber trastuzumabe deruxtecano ou quimioterapia a escolha do investigador (paclitaxel ou irinotecano).
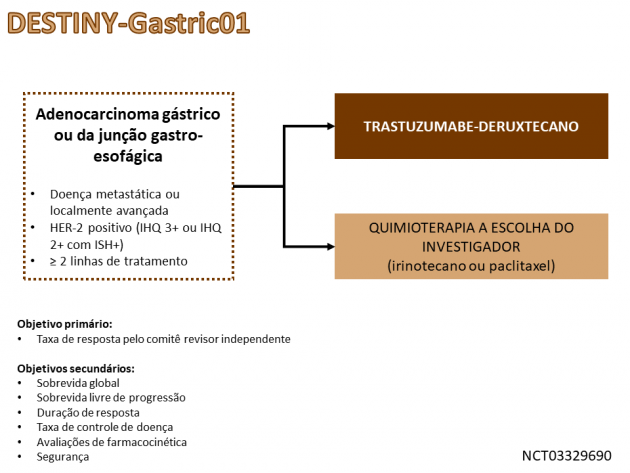
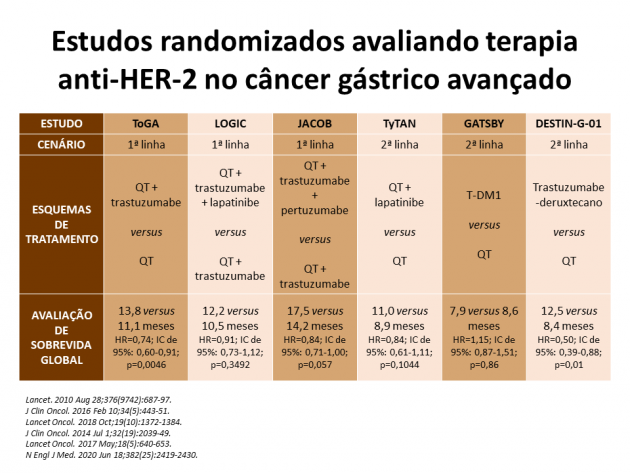
A taxa de resposta avaliada pelo comitê independente, objetivo primário do estudo, foi de 51% versus 14% nos braços do anticorpo e quimioterapia, respectivamente (p<0,001). Os objetivos secundários do estudo também favoreceram o braço que recebeu tratamento com o anticorpo conjugado a droga, dentre eles destacam-se a sobrevida global (medianas de 12,5 versus 8,4 meses; HR=0,50; IC de 95%: 0,39-0,88; p=0,01), sobrevida livre de progressão (5,6 versus 3,5 meses; HR=0,47; IC de 95%: 0,31-0,71) e duração de resposta (11,3 versus 3,9 meses).
Ressalta-se também que, conforme análise pré-especificada, a taxa de resposta a trastuzumabe deruxtecano foi diretamente relacionada à expressão de HER-2, sendo 58% nos pacientes com escore 3+ pela avaliação imuno-histoquímica, enquanto foi 29% naqueles com escore 2+ e hibridização in situ positiva. Nas avaliações de segurança, a taxa de eventos adversos de graus ≥ 3 relacionados ao tratamento foi 85,6% no braço trastuzumabe deruxtecano, destacando-se neutropenia, anemia, leucopenia, redução do apetite e plaquetopenia como os eventos adversos apresentados em maior frequência. Também é notório que 10% dos pacientes do braço trastuzumabe deruxtecano apresentaram doença intersticial pulmonar ou pneumonite, um evento adverso frequentemente relacionado a essa droga em diferentes estudos, porém a maior parte dos casos foi de graus leves.
Por Dr. Daniel Vargas P. de Almeida
