Continue sua leitura
Nivolumabe é aprovado para o tratamento do câncer gástrico e adenocarcinoma esofágico em combinação a quimioterapia nos EUA
O FDA (Food and Drug Administration) aprovou em 16 de abril de 2021 o uso do anticorpo monoclonal anti-PD-1 nivolumabe em combinação a quimioterapia baseada em fluoropirimidina e platina para o tratamento de primeira linha do câncer gástrico, do adenocarcinoma da junção gastroesofágica (JGE) e do esôfago avançados, independente da expressão de PDL-1.
A aprovação é baseada no estudo de fase III CheckMate 649, que randomizou 1.581 pacientes portadores de câncer gástrico ou adenocarcinoma da JGE ou esôfago localmente avançados ou metastáticos entre terapia sistêmica de primeira linha com quimioterapia (regimes mFOLFOX6 ou CAPOX) isolada ou combinada a nivolumabe. Destaca-se que a maior parte dos pacientes possuía tumores primários do estômago (70%) e 60% da população incluída no estudo apresentava expressão de PDL-1 ≥ 5 avaliada através do escore positivo combinado (CPS).
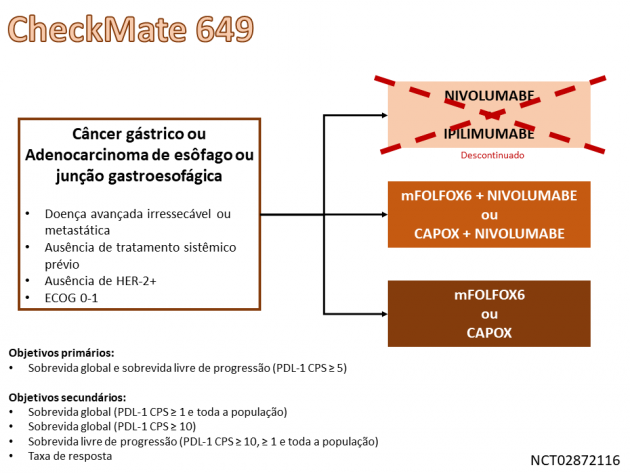
Os objetivos primários do estudo foram alcançados, demonstrando que a combinação de quimioterapia e nivolumabe reduziu em 32% o risco de progressão de doença ou morte (HR=0,68; IC de 95%: 0,58-0,79; p<0,0001), além de demonstrar um ganho de 3,3 meses na sobrevida global mediana (11,1 versus 14,4 meses; HR=0,71; IC de 95%: 0,61-0,83; p<0,0001) dentre os pacientes com expressão de PDL-1 ≥ 5 por CPS. A taxa de resposta também foi superior com o tratamento combinado nesta população selecionada (60% versus 45%, p<0,0001), incluindo 12% de respostas completas no braço que recebeu nivolumabe. Adicionalmente, dentre os objetivos secundários do estudo, o regime combinado também demonstrou superioridade em sobrevida livre de progressão (HR=0,77; IC de 95%: 0,68-0,87) e sobrevida global (HR=0,80; IC de 95%: 0,71-0,90; p=0,0002) na análise de todos os pacientes randomizados.
Na análise de segurança, os eventos adversos mais frequentes com o regime combinado foram neuropatia periférica, náuseas, fadiga, diarreia, vômito, redução do apetite, dor abdominal, constipação e dor musculoesquelética.
“É a primeira aprovação para tratamento de primeira linha de adenocarcinoma gastroesofageano metastático em mais de 10 anos, um importante avanço para os pacientes”, ressaltou Dr. Lucas dos Santos, oncologista da BP – A Beneficência Portuguesa de São Paulo. “Necessitamos, entretanto, compreender melhor o papel do CPS neste contexto, notadamente porque esse estudo utilizou o anticorpo 28-8, para melhor definirmos qual população pode derivar maior benefício da adição de nivolumabe”.
Por Dr. Daniel Vargas P. de Almeida
