Continue sua leitura
Terapia-alvo é aprovada para o tratamento do colangiocarcinoma avançado nos EUA
Apesar de raro, com incidência estimada de aproximadamente 8.000 casos novos ao ano na população norte-americana, o colangiocarcinoma é um tumor associado a prognóstico desfavorável, com taxa de sobrevida aos 5 anos inferior a 5% no cenário de doença avançada. Estudos desenvolvidos na busca de ampliar as opções terapêuticas para pacientes portadores dessa neoplasia apontam que aproximadamente 9-14% dos casos apresentam fusões do gene FGFR2. Diante desse cenário, o FDA (Food and Drug Administration) aprovou em 17 de abril o inibidor seletivo de FGFR1, FGFR2 e FGFR3 pemigatinibe para o tratamento de pacientes com colangiocarcinoma localmente avançado ou metastático portadores de fusão ou rearranjo do gene FGFR2 após exposição prévia a ao menos uma linha de tratamento sistêmico.
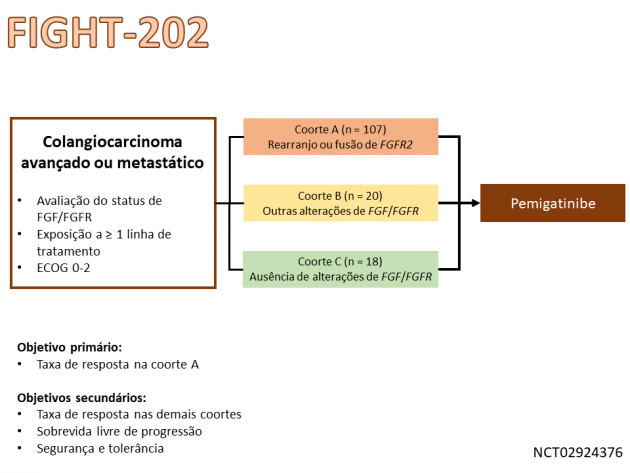
A aprovação anunciada é baseada nos dados do estudo de fase II FIGHT-202, que avaliou o tratamento com pemigatinibe em 146 pacientes divididos em 3 coortes: 107 pacientes com fusão ou rearranjo de FGFR2, 20 pacientes com outras alterações de FGF/FGFR e 18 pacientes sem alterações. Após um seguimento mediano de 17,8 meses, 35,5% dos pacientes com fusão ou rearranjo de FGFR2 apresentaram resposta ao tratamento com pemigatinibe. A duração mediana do benefício foi 7,5 meses. Nessa mesma coorte, a sobrevida livre de progressão mediana foi 6,9 meses, e a sobrevida global mediana foi de 21,1 meses. No tocante à segurança, 64% dos pacientes tratados com pemigatinibe apresentaram eventos adversos de graus ≥ 3, destacando-se hipofosfatemia, artralgia, estomatite, hiponatremia, dor abdominal e fadiga como as toxicidades mais frequentes.
Por Dr. Daniel Vargas P. de Almeida
