Continue sua leitura
Regime terapêutico com nivolumabe e ipilumumabe é aprovado para o tratamento do carcinoma hepatocelular nos EUA
A agência regulatória norte-americana FDA (Food and Drug Administration) aprovou em 11 de março o uso da combinação dos agentes imunoterápicos nivolumabe e ipilimumabe, anticorpos monoclonais anti-PD-1 e anti-CTLA-4, respectivamente, para o tratamento de pacientes com carcinoma hepatocelular avançado previamente tratados com sorafenibe.
A combinação de drogas aprovada foi avaliada em uma das coortes do estudo de fase I/II CheckMate 040, que avalia o tratamento de pacientes com carcinoma hepatocelular avançado Child-Pugh A5 ou A6 relacionados ou não aos vírus B ou C e previamente tratados com sorafenibe (com progressão ou toxicidade limitante) utilizando diferentes regimes terapêuticos. Em relação ao regime aprovado, 49 pacientes receberam tratamento com nivolumabe na dose de 1 mg/kg associado a ipilimumabe 3 mg/kg ambos IV a cada 3 semanas por quatro ciclos, seguidos da administração de nivolumabe 240 mg IV a cada 2 semanas até progressão de doença ou toxicidade limitante. O tratamento foi associado a uma taxa de resposta de 33%, incluindo 4 (8%) pacientes que apresentaram respostas completas, com 31% dos respondedores apresentando duração do benefício por ao menos 2 anos. A taxa de eventos adversos de graus igual ou superior a 3 foi de 53%, destacando-se como os eventos adversos relacionados ao tratamento mais prevalentes: prurido, rash cutâneo, elevação de transaminases e diarreia.

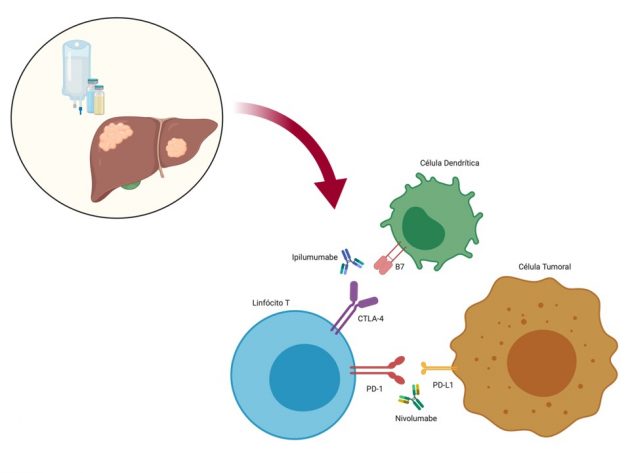
“Trata-se de mais um estudo demonstrando a atividade da imunoterapia no cuidado dos pacientes com carcinoma de células hepáticas. Devemos nos lembrar de que a combinação estudada, ipilimumabe 3mg/kg combinada a nivolumabe 1mg/kg, sabidamente mais tóxica do que ipilimumabe 1mg/kg combinada a nivolumabe 3mg/kg, foi a que apresentou melhor desempenho em eficácia, numericamente, o que levou à agência regulatória dos EUA à aprovação acelerada. Esta combinação está em teste, em comparação com o então tratamento padrão atualmente aprovado de primeira linha de carcinoma de células hepáticas (lenvatinibe ou sorafenibe) em um grande estudo de fase III, internacional. O recrutamento iniciar-se-á em breve no Brasil”, comentou o Dr. Lucas V. dos Santos, oncologista da BP, a Beneficência Portuguesa de São Paulo.
“A incorporação de imunoterapia no cuidado de pacientes com carcinoma de células hepáticas mudará substancialmente nos próximos meses”, completou o Dr. dos Santos.
Por Dr. Daniel Vargas P. de Almeida
