Continue sua leitura
Imunoterapia aprovada para tratamento do carcinoma hepatocelular
O agente imunoterápico anti-PD-1 pembrolizumabe recebeu aprovação acelerada pela agência norte-americana FDA no dia 09 de novembro de 2018 para o tratamento do carcinoma hepatocelular avançado em pacientes previamente tratados com sorafenibe que tiveram seu tratamento suspenso por progressão de doença ou toxicidade limitante.
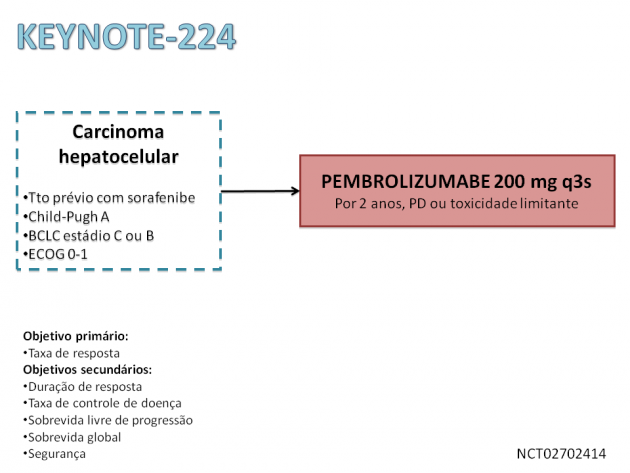
O tratamento com pembrolizumabe nesse cenário é embasado no estudo de fase II KEYNOTE-224, que avaliou a eficácia e segurança do tratamento com pembrolizumabe em 104 pacientes com carcinoma hepatocelular com escore Child-Pugh A que haviam recebido tratamento prévio com sorafenibe. O tratamento imunoterápico promoveu resposta objetiva em 17% dos pacientes, sendo que a maioria destes (56%) apresentou resposta com duração de mais de 12 meses. As medianas de sobrevida livre de progressão e sobrevida global foram de 4,9 e 12,9 meses, respectivamente.
Entre os pacientes tratados com pembrolizumabe, a taxa de eventos adversos de graus 3-5 foi de 26%, com um único evento grau 4 (hiperbilirrubinemia), e um evento adverso fatal (esofagite erosiva). Destacam-se entre os eventos adversos mais comuns a elevação de transaminases e fadiga.
Segundo o Dr. Lucas dos Santos, oncologista da BP – A Beneficência Portuguesa de São Paulo, “a aprovação acelerada pelo FDA garante acesso precoce dos pacientes a terapias inovadoras de doenças pouco frequentes ou com grande necessidade de tratamento, como é o carcinoma hepatocelular, que representa o tipo de câncer de fígado mais comum e tem comportamento agressivo. Entretanto, está condicionada a resultados de estudos clínicos adicionais para uma aprovação definitiva. Previamente, em setembro de 2017, um outro agente anti-PD-1, o nivolumabe, havia conseguido também aprovação acelerada pela mesma agência”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
