Continue sua leitura
Nivolumabe é aprovado pela ANVISA no cenário adjuvante para o tratamento do câncer de esôfago e da junção gastroesofágica
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 30 de agosto de 2021 o uso de nivolumabe como tratamento adjuvante em pacientes portadores de câncer de esôfago ou da junção gastroesofágica (JGE) que apresentam doença residual após protocolo de quimioirradiação seguido de cirurgia, independente da expressão de PDL-1.
A aprovação foi baseada nos dados do estudo de fase III CheckMate 577, no qual 794 pacientes portadores de câncer gástrico ou da JGE submetidos a cirurgia de ressecção completa com margens negativas após protocolo de quimioterapia combinado a radioterapia que apresentaram doença residual patológica foram randomizados a uma razão 2:1 entre nivolumabe ou placebo adjuvantes por 1 ano. Dentre a população incluída no estudo, cerca de 70% dos pacientes eram adenocarcinoma, aproximadamente 15% eram PDL-1 ≥ 1% e próximo de dois terços dos pacientes possuíam doença residual em linfonodo (≥ ypN1).
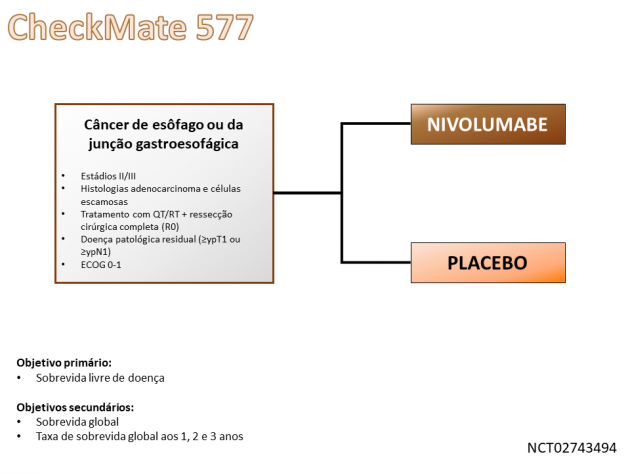
O tratamento adjuvante com nivolumabe resultou em redução de 31% no risco de recorrência de doença ou morte em comparação a placebo (HR=0,69; IC de 96,4%: 0,56-0,86; p=0,0003), objetivo primário do estudo, com sobrevida livre de doença mediana de 22,4 versus 11,0 meses nos braços nivolumabe e placebo, respectivamente. O benefício em sobrevida livre de doença foi consistente entre as histologias escamosa (HR=0,61) e adenocarcinoma (HR=0,75), bem como naqueles com baixa ou alta expressão de PDL-1 (HR=0,73 e HR=75 para PDL-1 <1% e ≥1%, respectivamente). A sobrevida livre de metástases à distância, um objetivo exploratório do estudo, também favoreceu o braço que recebeu tratamento adjuvante com nivolumabe (HR=0,74; IC de 95%: 0,60-0,92). A taxa de eventos adversos de graus ≥ 3 relacionados ao tratamento com nivolumabe foi de 13%, sendo fadiga, diarreia, prurido, rash e hipotireoidismo os eventos adversos mais comuns.
A posologia utilizada no estudo foi nivolumabe 240 mg, via intravenosa, a cada duas semanas durante 16 semanas, seguido de nivolumabe 480 mg a cada quatro semanas até a recorrência de doença, toxicidade limitante ou conclusão de um ano de tratamento.
O Dr. Ricardo Carvalho, oncologista clínico da BP – A Beneficência Portuguesa de São Paulo, destaca: “esta é mais uma aprovação que reforça o papel da imunoterapia nos tumores gastroesofágicos. Apesar de ainda não sabermos se existe benefício em sobrevida global, devido o curto tempo de seguimento, o impacto em sobrevida livre de doença é de grande relevância clínica (o tempo mediano deste desfecho no braço nivolumabe foi mais que o dobro daquele atingido no braço placebo). Esta aprovação muda a prática atual e deve ser incorporada por todos nós já no próximo paciente com câncer de esôfago ou da junção gastroesofágica (JGE) que apresente doença residual após quimioirradiação seguido de cirurgia”.
Por Dr. Daniel Vargas P. de Almeida
