Continue sua leitura
ANVISA aprova nova indicação de tratamento para o quimioterápico TAS-102
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 02 de setembro de 2021 o uso de TAS-102 (trifluridina/tipiracil) para o tratamento de pacientes portadores de câncer gástrico ou da junção gastroesofágica (JGE) avançado previamente expostos a pelo menos dois regimes terapêuticos para a doença avançada.
Esta nova indicação terapêutica é baseada nos resultados do estudo fase III TAGS, que randomizou 507 pacientes de 17 países com câncer de estômago (71%) ou JGE (29%) metastáticos que apresentaram progressão a dois ou mais regimes quimioterápicos prévios para receberem TAS-102 ou placebo, numa razão de 2:1. Foram incluídos pacientes extensamente pré-tratados, com mediana de 3 linhas prévias, sendo que 99,8% da população eram previamente expostos a fluoropirimidina, 100% haviam recebido platinantes e 90,5% previamente tratados com taxanos. Além disso, 33,3% e 16,6% haviam recebido ramucirumabe e trastuzumabe previamente, respectivamente.
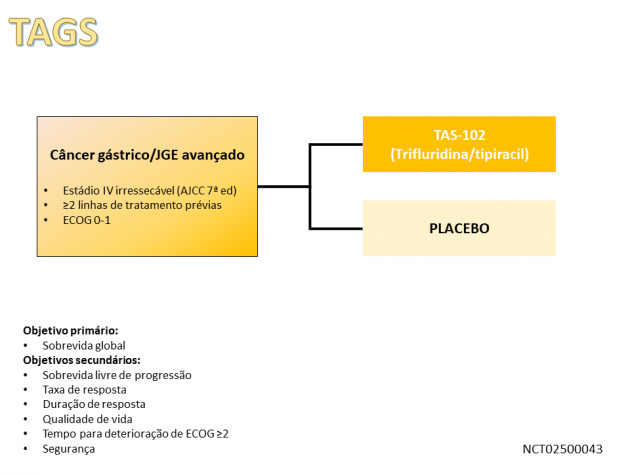
Com um seguimento mediano de 10,7 meses, o tratamento com TAS-102 promoveu benefício em sobrevida global, objetivo principal do estudo, com mediana de 5,7 versus 3,6 meses para aqueles que receberam TAS-102 e placebo, respectivamente (HR=0,69; IC de 95%: 0,56-0,85; p=0,00058). A taxa de controle de doença nos pacientes que receberam tratamento com TAS-102 foi de 44%, com taxa de resposta de 4%. Houve ainda melhora na sobrevida livre de progressão no grupo que recebeu TAS-102 (HR=0,57; IC de 95%: 0,47-0,70; p<0,0001). Cerca de 80% dos pacientes que receberam a droga apresentaram eventos adversos de grau 3 ou superior, principalmente eventos adversos hematológicos: neutropenia, anemia e leucopenia.
Por Dr. Daniel Vargas P. de Almeida
