Continue sua leitura
Avelumabe é aprovado para o tratamento de manutenção do carcinoma urotelial avançado nos EUA
A agência regulatória americana FDA (Food and Drug Administration) aprovou em 30 de junho de 2020 o anticorpo anti-PDL-1 avelumabe como tratamento de manutenção após quimioterapia baseada em platina em pacientes portadores de carcinoma urotelial localmente avançado ou metastático, baseado nos dados do estudo de fase III JAVELIN Bladder 100.
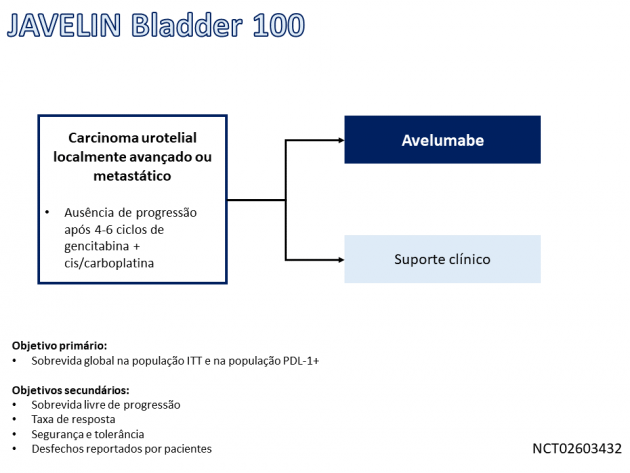
Nesse estudo, 700 pacientes com carcinoma urotelial localmente avançado irressecável ou metastático que apresentaram doença estável ou resposta ao tratamento de primeira linha com 4-6 ciclos de gencitabina combinada a cisplatina ou carboplatina foram randomizados entre tratamento de manutenção com avelumabe ou suporte clínico. Os resultados do estudo foram apresentados na sessão plenária da ASCO 2020 e demonstraram que o uso de avelumabe foi associado a uma redução de 31% no risco de morte em comparação ao braço controle (HR=0,69; IC de 95%: 0,56-0,86; p < 0,001). A sobrevida global mediana foi 21,4 meses no braço avelumabe e 14,3 meses no braço controle. O benefício foi ainda maior na análise pré-determinada da população com expressão de PDL-1 positiva (HR=0,56; IC de 95%: 0,40-0,79; p < 0,001). A sobrevida livre de progressão também favoreceu o uso de avelumabe (HR=0,62; IC de 95%: 0,52-0,75; p < 0,001). A taxa de resposta com o uso do anticorpo foi 9,7%, destacando-se 6% de respostas completas. Quanto à segurança do tratamento, a taxa de eventos adversos de graus ≥ 3 foi 47,4%, sendo fadiga, prurido, infecção do trato urinário, diarreia e artralgia os efeitos adversos mais frequentes em qualquer grau.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
