Continue sua leitura
ANVISA aprova novo regime de administração de pembrolizumabe
A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou recentemente a inclusão de um novo regime de administração do anticorpo monoclonal anti-PD-1 pembrolizumabe na dose de 400 mg a cada 6 semanas para todas as indicações de tratamento utilizando a droga em monoterapia. Previamente, o regime de tratamento aprovado consistia na administração padrão de 200 mg a cada 3 semanas. No Brasil, o uso de pembrolizumabe em monoterapia é aprovado nos seguintes cenários:
- Melanoma:
- Tratamento adjuvante após ressecção cirúrgica completa;
- Tratamento da doença avançada.
- Câncer de pulmão de células não-pequenas:
- Tratamento de primeira linha da doença avançada com PDL-1 ≥ 1%;
- Tratamento da doença avançada com PDL-1 ≥ 1% após exposição a terapia prévia.
- Carcinoma urotelial:
- Tratamento da doença avançada após exposição a quimioterapia baseada em platina;
- Tratamento de primeira linha da doença avançada em pacientes não elegíveis a tratamento com cisplatina e PDL-1 positivo (CPS ≥ 10).
- Câncer gástrico/Junção gastresofágica (adenocarcinoma):
- Tratamento da doença avançada PDL-1 positiva (CPS ≥ 1) após exposição a pelo menos duas linhas de tratamento prévias.
- Linfoma de Hodgkin clássico:
- Tratamento da doença refratária ou recidivada após ao menos três linhas de tratamento prévias.
- Câncer de cabeça e pescoço (carcinoma escamoso):
- Tratamento de primeira linha da doença avançada PDL-1 positiva (CPS ≥ 1).
- Câncer esofágico:
- Tratamento da doença avançada PDL-1 positiva (CPS ≥ 10) após exposição prévia a uma linha de tratamento.
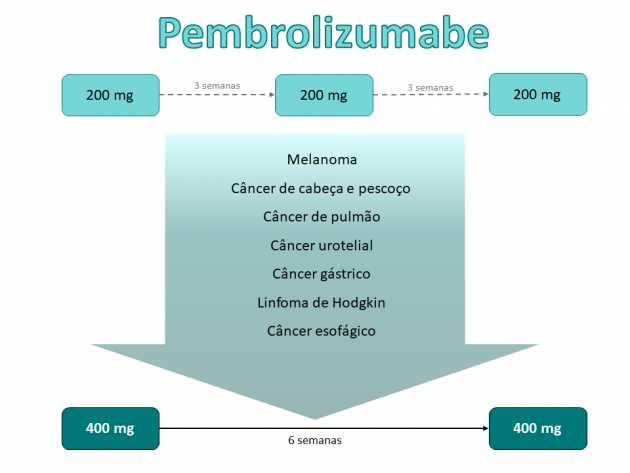
Esse regime de administração estendido é baseado em estudo de exposição-resposta apresentado na ASCO 2018, sugerindo eficácia e segurança semelhantes entre o regime de administração estendido e o regime padrão em avaliação de dados farmacocinéticos, e já havia sido aprovado pela agência regulatória europeia EMA (European Medicina Agency) no primeiro semestre de 2019.
O novo regime de tratamento já é exibido na bula do medicamento, disponível no bulário eletrônico da ANVISA.
Por Dr. Daniel Vargas P. de Almeida
