Continue sua leitura
O que muda no MOC após a ASCO 2020

O congresso anual da sociedade americana de oncologia clínica (ASCO 2020) ocorreu entre os dias 29 e 31 de maio através de um formato completamente virtual em decorrência da pandemia de COVID-19. A equipe do MOC-News apresenta um resumo dos trabalhos de maior relevância para a prática clínica com comentários dos editores do MOC, Drs. Antônio Carlos Buzaid, Fernando Cotait Maluf, Caio Max S. Rocha Lima, William N. William e Carlos H. Barrios.
Câncer de mama
Estudo de fase III que randomizou 1846 pacientes com câncer de mama HER-2 positivo em estádio inicial de alto risco (comprometimento linfonodal ou na ausência de linfonodos comprometidos, tumores ≥ 2 cm com receptores hormonais negativos) entre pertuzumabe associado a T-DM1 (AC-KP) ou a trastuzumabe + taxano (AC-THP) após tratamento adjuvante com antracíclico. Como resultado, não houve benefício em sobrevida livre de doença invasiva com o uso do regime AC-KP, objetivo primário do estudo, entretanto ambos os regimes foram associados a altas taxas de sobrevida livre de doença invasiva em 3 anos (94% para AC-THP e 93% para AC-KP).
Comentário:
Este estudo não muda a prática clínica, mas oferece uma opção a mais para pacientes HER-2 positivas e ressalta a eficácia dos tratamentos que temos disponíveis para estas pacientes.
Atualização dos dados do estudo TRAIN-2, que avalia um regime terapêutico alternativo sem o uso de antracíclico no tratamento neoadjuvante de pacientes com câncer de mama HER-2 positivo, comparando o regime de paclitaxel, trastuzumabe, carboplatina e pertuzumabe (PTC+P) por 9 ciclos ao regime de 5-fluorouracil, epirrubicina, ciclofosfamida, trastuzumabe e pertuzumabe (FEC-T+P) por 3 ciclos seguido de PTC+P por 6 ciclos. Ambos os braços receberam trastuzumabe até completar um ano de tratamento. A taxa de resposta completa, objetivo primário do estudo, já havia sido apresentada previamente, demonstrando alta atividade em ambos os regimes (68% e 67% nos braços PTC-P e FEC-T+P, respectivamente). A análise atualizada com 48,8 meses de acompanhamento demonstrou que não houve diferença na sobrevida livre de eventos nem na sobrevida global aos 3 anos, entre os braços, com menores taxas de toxicidade cardiológica (redução na fração de ejeção do ventrículo esquerdo) no grupo sem antracíclico. Duas pacientes desenvolveram leucemia aguda nas pacientes tratadas com epirrubicina.
Comentário:
Este estudo aliado ao BCIRG006 demonstra que não há necessidade de usar antracíclicos em pacientes HER-2 positivas, reduzindo assim cardiotoxicidade e incidência de leucemia aguda e mielodisplasia induzidas por antracíclico.
Estudo chinês que avaliou o regime de capecitabina metronômica (600mg/m2 duas vezes ao dia) administrada por 1 ano como manutenção após terapia padrão no tratamento de pacientes com câncer de mama triplo-negativo operado. Dentre as 434 pacientes randomizadas entre capecitabina ou observação, o braço que recebeu capecitabina apresentou redução no risco de recorrência de doença em 5 anos quando comparado a observação (83% versus 73%; HR=063; IC de 95%: 0,42-0,96; p = 0,027) e redução no risco de doença a distância (HR=0,56; IC de 95%: 0,37-0,90; p = 0,016). Entretanto, não houve diferença na taxa de sobrevida aos 5 anos entre os grupos.
Comentário:
Embora a indicação da quimioterapia neoadjuvante ou adjuvante esteja estabelecida em pacientes com tumores triplo-negativos, este estudo demonstra que em casos já operados, pode-se considerar capecitabina metronômica adjuvante por 1 ano após o tratamento convencional ter sido administrado (quimioterapia e radioterapia adjuvante).
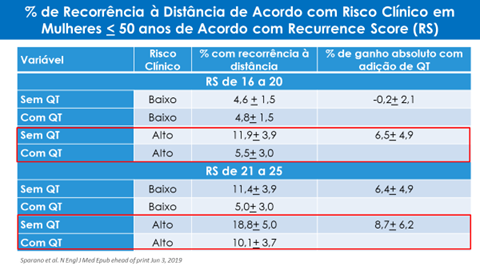
Atualização do estudo MINDACT com um seguimento mediano de 8,7 anos. Em relação aos dados anteriormente apresentados, houve um aumento na diferença absoluta da taxa de sobrevida livre de metástases a distância entre os braços que receberam quimioterapia adjuvante ou não dentre o subgrupo de pacientes com características clínicas de alto risco e avaliação genômica de baixo risco (clinical risk high e Mammaprint low risk), passando de 0,9% para 2,6%. Quando as pacientes foram estratificadas de acordo com a faixa etária, essa diferença absoluta chegou a 5% naquelas com idade ≤ 50 anos. No grupo de mulheres pré-menopáusicas, destaca-se que a maioria recebeu apenas tamoxifeno por 5 anos como terapia hormonal adjuvante, sem o emprego de supressão ovariana.
Comentário:
Esta atualização gera grande preocupação em continuar usando Mammaprint em mulheres jovens de risco clínico alto. Quando se avaliam os dados do Oncotype Dx, observamos que para pacientes com risco clínico alto e com RS de 16 a 25, a adição de quimioterapia adjuvante aumenta o intervalo livre de doença em aproximadamente 7,5%, sugerindo que para este grupo de pacientes, a exclusão da quimioterapia possa não ser a melhor estratégia. Foi levantada a possibilidade de que o bloqueio ovariano junto com hormonioterapia (inibidor da aromatase), possa ser uma alternativa para estas pacientes, mas esta estratégia não tem estudos comparativos definitivos com a quimioterapia nesta população. Estamos, portanto, sem uma boa assinatura para mulheres jovens. Como o Oncotype permite melhor avaliar o risco através do RS, será preferido neste contexto.
Estudo de fase III avaliando a adição do anticorpo anti-PD-1 pembrolizumabe ao tratamento quimioterápico de primeira linha do câncer de mama triplo-negativo avançado. Como resultado, a adição de pembrolizumabe reduziu o risco de progressão de doença ou morte (HR=0,65; IC de 95%: 0,49-0,86; p = 0,0012) na população de pacientes com alta expressão de PD-L1 (escore positivo combinado [CPS] ≥ 10).
Comentário:
Este estudo, assim como o já apresentado IMpassion 130, demonstra que a imunoterapia veio para ficar em câncer de mama triplo-negativo complementando a quimioterapia. Vale ressaltar, entretanto, que hoje somente atezolizumabe mais nab-paclitaxel é aprovado para pacientes com câncer de mama triplo negativo com PDL-1 positivo pelo anticorpo SP142 nas células imunes.
Análise de subgrupo das pacientes com metástases cerebrais incluídas no estudo HER2CLIMB. O braço de pacientes com metástases cerebrais que recebeu tucatinibe apresentou benefício em sobrevida livre de progressão no sistema nervoso central (HR=0,32; IC de 95: 0,22-0,48; p < 0,00001), sobrevida global (HR=0,58; IC de 95%: 0,40-0,85; p = 0,005) e taxa de resposta (47% versus 20%; p = 0,03), quando comparado ao braço placebo.
Comentário:
Claramente este esquema representa a melhor opção para pacientes com câncer de mama HER-2 positivo e metástases cerebrais. Infelizmente, esta droga não está ainda aprovada no Brasil.
Estudo de fase III apresentado na sessão plenária que avaliou a abordagem do tumor primário em pacientes com câncer de mama apresentando doença metastática ao diagnóstico. Como resultado do estudo, a abordagem do tumor primário não foi associada a benefício em sobrevida global (HR=1,09; IC de 90%: 0,80-1,49; p = 0,63) ou sobrevida livre de progressão (p=0,40) em comparação ao tratamento sistêmico isolado.
Comentário:
Embora este estudo demonstre que a abordagem do tumor primário não afete a sobrevida global, não é possível excluir um potencial ganho em situações mais específicas como em mulheres com doença oligometastática. O número de pacientes com doença triplo-negativa foi relativamente baixo nesta amostra. Estudo adicionais (que se encontram em andamento) com um número maior de pacientes são ainda justificados.
Câncer de pulmão
Estudo de fase III apresentado na sessão plenária que avaliou o uso de osimertinibe no tratamento adjuvante de pacientes com câncer de pulmão de células não pequenas estádios IB-IIIA com mutação de EGFR. O uso de quimioterapia adjuvante era permitido à escolha do investigador. O estudo atingiu seu objetivo primário, demonstrando uma redução de 83% no risco de recorrência de doença nos pacientes com doença estádios II-IIIA (HR=017; IC de 95%: 0,12-0,23; p < 0,0001), além de também demonstrar benefício quando toda a população foi analisada (HR=0.21; IC de 95%: 0,16-0,28; p<0.0001). A análise de sobrevida global ainda é bastante imatura.
Comentário:
Este estudo é practice changing e esperamos a aprovação do osimertinibe nesta indicação em futuro próximo.
O uso de tratamento local com radioterapia no câncer de pulmão oligometastático de células não pequenas foi avaliado nesse estudo de fase III. Nele, 133 pacientes portadores de tumores apresentando mutação do EGFR foram randomizados entre inibidor de tirosina quinase (gefinitibe, erlotinibe ou icotinibe) isolado versus radioterapia estereotática (SBRT) para até 5 sítios de doença metastática seguida de inibidor. Como resultados, a adição de SBRT ao tratamento sistêmico foi associada a benefício em sobrevida livre de progressão (HR=0,618; IC de 95%: 0,394-0,969; p < 0,001) e sobrevida global (HR=0,682; IC de 95%: 0,456-1,001; p < 0,001) na análise interina dos dados.
Comentário:
Embora o osimertinibe seja hoje o tratamento de escolha de primeira linha para pacientes com mutação sensível do EGFR, os dados deste estudo são provavelmente extrapoláveis para o osimertinibe.
Selpercatinib (LOXO-292) in patients with RET-fusion+ non-small cell lung cancer.
Dois estudos apresentando alta eficácia de selpercatinibe no tratamento de pacientes com câncer de pulmão de células não pequenas metastático com fusão de RET. Na população previamente exposta a quimioterapia baseada em platina a taxa de resposta foi 64%. Já naqueles tratados na primeira linha, a taxa de resposta foi 85%. Em relação aos pacientes com metástases cerebrais, a taxa de resposta intracraniana foi 81,8%, com duração mediana do benefício de 9,4 meses.
Comentário:
Selpercatinibe é o novo padrão para fusão de RET, porém, infelizmente ainda não foi aprovada no Brasil.
Nesse estudo, a atividade de capmatinibe foi avaliada em pacientes com câncer de pulmão de células não pequenas metastático com amplificação do MET. A taxa de resposta a capmatinibe na primeira linha de tratamento foi 40%, enquanto o mesmo desfecho foi 29% naqueles pacientes previamente tratados.
Comentário:
Capmatinibe já foi aprovado nos Estados Unidos para uso em câncer de pulmão com mutações de MET do tipo exon 14 skipping e esses dados corroboram a atividade dessa droga também em pacientes com ganho do número de cópias de MET.
O uso de trastuzumabe deruxtecano foi avaliado nesse estudo de fase II em pacientes com câncer de pulmão de células não pequenas metastático apresentando mutação de HER-2. A taxa de resposta à droga foi 61,9%, a duração mediana de resposta não foi alcançada e a sobrevida livre de progressão mediana foi 14,0 meses dentre os 42 pacientes avaliados. A taxa de eventos adversos de graus ≥ 3 foi 64,3%, entretanto apenas 5 pacientes apresentaram doença intersticial pulmonar (todos de grau 2), uma toxicidade característica dessa droga.
Comentário:
Embora T-DM1 seja ativo neste contexto (taxa de resposta da ordem de 30%), trastuzumabe deruxtecano parece mais ativo e irá se tornar o novo padrão logo que disponível no Brasil.
Atualização do estudo CheckMate 227, confirmando o benefício em sobrevida global com o uso de nivolumabe e ipilimumabe na primeira linha quando comparados a quimioterapia (HR=0,79; IC de 95%: 0,67-0,93) em pacientes portadores de câncer de pulmão de células não pequenas avançado com PDL-1 ≥ 1%. Em análise exploratória na população com PD-L1 < 1%, o regime imunoterápico combinado também demonstrou benefício em sobrevida global em comparação a quimioterapia (HR=0,64; IC de 95%: 0,51-0,81).
Comentário:
Nos Estados Unidos, nivolumabe e ipilimumabe foram aprovados para uso em pacientes com PDL-1 ≥ 1%.
Apresentação dos dados do estudo CheckMate 9LA que randomizou pacientes com câncer de pulmão de células não pequenas metastático para tratamento com nivolumabe e ipilimumabe associados a 2 ciclos de quimioterapia ou 4 ciclos de quimioterapia isolada. O braço que recebeu nivolumabe e ipilimumabe apresentou benefício em sobrevida global (HR=0,66; IC de 95%: 0,55-0,80) em comparação ao uso de quimioterapia isolada, além de benefício em sobrevida livre de progressão (HR=0,68; IC de 95%: 0,57-0,82) e maior taxa de resposta (38% versus 25%). Esse estudo demonstra que a quimioterapia pode ser restringida a apenas dois ciclos quando combinada a nivolumabe e ipilimumabe.
Comentário:
Nos Estados Unidos, os esquemas de tratamento do CheckMate 9LA já foram aprovados pelas agências regulatórias, independente da expressão de PD-L1.
Tumores Geniturinários
Trabalho apresentado na sessão plenária que randomizou 700 pacientes com carcinoma urotelial metastático apresentando ausência de progressão a quimioterapia de primeira linha entre tratamento de manutenção com avelumabe ou melhor suporte clínico. O estudo atingiu seu objetivo primário, demonstrando que o uso de avelumabe foi associado a uma redução de 31% no risco de morte em comparação a suporte clínico (HR=0,69; IC de 95%: 0,56-0,86; p = 0,0005), com sobrevidas medianas de 21,4 e 14,3 meses, respectivamente.
Comentário:
Este estudo muda a prática a clínica e estabelece o novo padrão de avelumabe de manutenção para os pacientes com carcinoma urotelial metastático que apresentam doença estável ou resposta (parcial ou completa) a platina e gencitabina.
Esse estudo randomizou 809 pacientes com carcinoma urotelial músculo-invasivo de alto risco previamente tratados com quimioterapia neoadjuvante (excetuando-se aqueles inelegíveis a cisplatina) e posteriormente submetidos a cistectomia radical para receberem atezolizumabe adjuvante ou observação. Com um seguimento mediano de 21,9 meses, o estudo foi negativo para seu objetivo principal, não demonstrando diferença na sobrevida livre de doença entre os grupos de tratamento (HR=0,89; IC de 95%: 0,74-1,08; p = 0,2446). A análise preliminar de sobrevida global também não demonstrou diferença entre os grupos (HR=0,85; IC de 95%: 0,66-1,09; p = 0,1951).
Comentário:
Por agora, somente quimioterapia baseado em cisplatina deve ser recomendada, preferencialmente como tratamento neoadjuvante, na doença músculo-invasiva.
Atualização do estudo de fase III KEYNOTE-426 que randomizou 861 pacientes com carcinoma de células renais avançado entre tratamento de primeira linha com pembrolizumabe e axitinibe ou sunitinibe. Com maior seguimento, o tratamento com pembrolizumabe e axitinibe manteve o benefício em sobrevida global (HR=0,68; IC de 95%: 0,55-0,85; p < 0,001), sobrevida livre de progressão (HR=0,71; IC de 95%: 0,60-0,84; p < 0,0001) e taxa de resposta (60,2% versus 39,9%; p < 0,0001) em comparação a sunitinibe em todos os grupos de risco do IMDC.
Comentário:
Este estudo reforça que a combinação de pembrolizumabe e axitinibe é umas das opções de escolha para os pacientes com câncer avançado de rim, tipo células claras, independente do risco. Outras opções neste cenário são a combinação de ipilimumabe e nivolumabe (para riscos intermediário e desfavorável) e avelumabe e axitinibe (para riscos favorável, intermediário e desfavorável).
O impacto do PET-CT PSMA no tratamento de pacientes com recorrência bioquímica do câncer de próstata foi avaliado nesse estudo de fase III. A taxa de detecção do exame foi cerca de 60%, e a taxa de localização correta (um desfecho semelhante ao valor preditivo positivo, com a adição de comprovação anatômica da lesão) foi aproximadamente 85% na análise de três diferentes avaliadores, com ambos os desfechos apresentando relação direta entre a performance do exame e o nível de PSA. Destaca-se que os resultados do PET-PSMA motivaram a alteração da intenção do tratamento em 63,9% dos pacientes.
Comentário:
Este estudo reforça o papel do PET-CT PSMA como exame de escolha na recorrência bioquímica do câncer de próstata.
Estudo de fase III avaliando o antagonista do receptor de GnRH oral relugolix versus leuprolida no tratamento de pacientes com câncer de próstata avançado. A droga oral demonstrou superioridade na taxa de castração sustentada em 48 semanas (96,7% versus 88,8%; p < 0,0001), além de estar associada a supressão de testosterona e repostas de PSA mais precoces em comparação a leuprolida, bem como menor intervalo para recuperação de testosterona após suspensão do tratamento. A taxa de eventos adversos foi semelhante entre os grupos, entretanto a taxa de eventos adversos cardiovasculares maiores foi menor no braço relugolix.
Comentário:
Este estudo coloca antagonista do receptor de GnRH oral relugolix como uma futura opção padrão no câncer de próstata avançado sensível a castração. Devido a maior eficácia (na supressão da testosterona) e segurança (do ponto de vista cardiovascular) quando comparado ao análogo do LHRH, a droga se assemelha ao antagonista de LHRH (degarelix). Porém, a posologia oral é um diferencial. Resta saber qual será o custo desta nova medicação quando ela for aprovada.
Estudo de fase II desenvolvido e conduzido no Brasil que avaliou três diferentes regimes terapêuticos – deprivação androgênica associada a abiraterona (braço 1), apalutamida monoterapia (braço 2), ou abiraterona combinada a apalutamida (braço 3) – no tratamento em pacientes com câncer de próstata avançado sensível a castração. Como resultados o estudo demonstrou alta taxa de PSA indetectável (≤ 0,2 ng/mL) nos regimes contendo abiraterona (73,8% no braço 1 e 70,5% no braço 2), com resultados de eficácia semelhantes entre os três grupos nos demais desfechos analisados. Adicionalmente a segurança mostrou perfis de toxicidade distintos entre os braços e resultados semelhantes na análise de qualidade de vida.
Comentário:
Este estudo provocador sugere que pode haver papel para tratamentos não baseados na deprivação hormonal na doença avançada sensível a castração. No entanto, torna-se necessário, um estudo de fase III para responder esta pergunta tendo como braço controle castração hormonal associado a um segundo agente.
Três diferentes estudos de fase III apresentados demonstrando que a incorporação de agentes atuantes no eixo do receptor androgênico – darolutamida, enzalutamida e apalutamida – à terapia de deprivação androgênica é associada a benefício em sobrevida global no tratamento de pacientes portadores de câncer de próstata não metastático resistente a castração.
Comentário:
Estes três estudos reforçam o papel destes três agentes como padrão na doença não metastática resistente a castração. Como os resultados dos três estudos são superponíveis, a escolha do agente deverá ser baseada no custo, acesso e perfil de efeitos colaterais.
Nesse estudo de fase II, 200 pacientes com câncer de próstata metastático resistente à castração previamente tratados com docetaxel foram randomizados entre lutécio 177-PSMA ou cabazitaxel. Dentre os resultados, o braço de lutécio PSMA apresentou maior taxa de redução de PSA ≥ 50% (66% versus 37%; p < 0,001), bem como benefício em sobrevida livre de progressão de PSA (HR = 0,69; IC de 95%: 0,50-0,95; p = 0,02). Na análise de segurança, a taxa de eventos adversos de graus ≥ 3 foi menor no braço tratado com lutécio 177-PSMA (35% versus 54%).
Comentário:
Este estudo coloca de modo mais sólido o papel do lutécio 177-PSMA como uma opção a ser considerada em pacientes com câncer de próstata metastático resistente à castração e expostos a pelo menos duas linhas de tratamento que prolonguem a sobrevida. A maior limitação desta estratégia é o acesso limitado e custo, devido a ausência de cobertura pelas operadoras de saúde.
Três diferentes estudos avaliando o papel de ipilimumabe em combinação a nivolumabe no tratamento de pacientes com progressão ou ausência de resposta durante exposição prévia a um anti-PD-1/PDL-1 através de diferentes abordagens. Como resultados, as taxas de resposta situaram-se entre 4% a 15,2% dentre os diferentes estudos, demonstrando a atividade limitada do combo no tratamento de resgate em pacientes previamente expostos a um inibidor de checkpoint.
Comentário:
Estes três estudos são interessantes, mas não mudam o padrão de segunda linha. Um estudo de fase 3 é necessário para avaliar esta combinação frente aos tratamentos padrão neste espaço como por exemplo cabozantinibe e axitinibe.
A combinação de bevacizumabe e erlotinibe foi avaliada no tratamento de 83 pacientes com carcinoma de células renais papilífero metastático nesse estudo de fase II que incluiu 42 pacientes portadores da síndrome de leiomiomatose hereditária e carcinoma de células renais (HLRCC) e 41 deles na coorte com doença esporádica. Aproximadamente um terço da população (33%) havia recebido ao menos uma linha de tratamento sistêmico prévia. A taxa de resposta com a combinação de bevacizumabe e erlotinibe foi 54,2% e a sobrevida livre de progressão mediana foi 14,3 meses quando toda a população foi avaliada. Na análise separada por coortes, os mesmos desfechos foram 72,1% e 21,1 meses, e 35% e 8,8 meses, nas coortes HLRCC e doença esporádica, respectivamente.
Comentário:
Estes resultados colocam a combinação de bevacizumabe e erlotinibe como uma opção padrão para pacientes com carcinoma de células renais papilífero metastático com ou sem HLRCC.
Estudo de fase II avaliando a combinação de lenvatinibe e pembrolizumabe no tratamento de pacientes com carcinoma renal de células claras metastático previamente expostos a um inibidor de checkpoint. A taxa de resposta com o tratamento combinado foi 52%, com duração mediana do benefício de 12 meses. Quando os resultados foram analisados de acordo com o regime imunoterápico prévio, o combo se mostrou eficaz tanto naqueles previamente tratados com anti-PD-1/PDL-1 em monoterapia, bem como naqueles que receberam a combinação de um anti-PD-1/PDL-1 com ipilimumabe ou um anti-VEGF.
Comentário:
Estes resultados são provocadores e demonstram alta atividade deste regime às custas de toxicidade elevada. Um estudo de fase III é justificado neste contexto.
Tumores Ginecológicos
O papel da cirurgia citorredutora de resgate foi avaliado nesse estudo de fase III que randomizou 407 pacientes com câncer de ovário recorrente platino-sensível entre quimioterapia sistêmica associada ou não a cirurgia. Como resultados, o braço que recebeu cirurgia citorredutora de resgate apresentou uma redução de 25% no risco de morte em comparação ao uso de quimioterapia isolada (HR=0,75; IC de 95%: 0,58-0,96; p = 0,02), com um ganho absoluto de 7,7 meses na sobrevida global mediana. Quando a análise foi conduzida nas pacientes que obtiveram ressecção cirúrgica completa, o ganho absoluto em sobrevida global foi de 15,9 meses (HR=0,57; IC de 95%: 0,43-0,76; p < 0,001).
Comentário:
Este estudo coloca a cirurgia citorredutora de resgate (preferencialmente completa e realizada em centros especializados) como o novo padrão, acrescida a quimioterapia baseada em platina, em pacientes com câncer de ovário recorrente platino-sensível.
Análise final de sobrevida global das pacientes incluídas no estudo de fase III SOLO2/ENGOT-ov21 demonstrando um benefício absoluto de 12,9 meses em sobrevida global com o uso de olaparibe como terapia de manutenção após tratamento quimioterápico (HR=0,74; IC de 95%: 0,54-1,00; p = 0,0537) em pacientes com resposta parcial ou completa após tratamento baseado em platina e mutação germinativa do BRCA 1 ou 2. A taxa de sobrevida em 5 anos foi 42%, sendo que 22% das pacientes permaneceram com tratamento de manutenção com olaparibe por ≥ 5 anos.
Comentário:
Este estudo reforça o papel de olaparibe como terapia de manutenção em pacientes com mutação do BRCA 1 ou 2 após exposição a tratamento quimioterápico na doença platino-sensível com resposta parcial ou completa.
O anticorpo conjugado a droga mirvetuximabe soravtansina foi avaliado no tratamento de pacientes com câncer de ovário avançado em combinação a bevacizumabe nesse estudo fase II. A taxa de resposta com o tratamento foi 47% em toda a população do estudo, e 64% naquelas pacientes com alta expressão de receptor de folato alfa, alvo do anticorpo. No tocante a segurança, a maior parte dos eventos adversos foi de baixo grau, e principalmente relacionados ao trato gastrintestinal e alterações oculares.
Comentário:
Estes resultados muito promissores colocam esta droga como uma opção futura de tratamento do câncer de ovário recidivado que apresentem expressão de receptor de folato alfa.
Estudo de fase III que avaliou o uso de quimiorradioterapia sequencial (cisplatina e paclitaxel), radioterapia isolada ou quimiorradioterapia concomitante (cisplatina) no tratamento adjuvante do carcinoma cervical estádios IB1-IIA2 após histerectomia e que apresentem fatores patológicos adversos (margem comprometida, parámetrio envolvido, invasão linfovascular, invasão estromal profunda, alto grau, linfonodos pélvicos comprometidos). O tratamento com quimiorradioterapia sequencial foi associado a benefício em sobrevida livre de doença e sobrevida global em comparação aos demais braços, sem acréscimo significativo de toxicidades (taxa de eventos adversos de graus ≥ 3 de 25,3%).
Comentário:
Estes resultados mudam o padrão, posicionando a adjuvância com quimiorradioterapia sequencial (cisplatina e paclitaxel por 2 ciclos seguido de radioterapia isolada seguido de cisplatina e paclitaxel por mais 2 ciclos), como regime de escolha em pacientes carcinoma cervical estádios IB1-IIA2 após histerectomia e que apresentem fatores patológicos adversos.
Tumores de sistema nervoso central
Alliance A071401: Phase II trial of FAK inhibition in meningiomas with somatic NF2 mutations.
Estudo de fase II avaliando o uso do inibidor de FAK GSK2256098 no tratamento de 32 pacientes com meningioma recorrente apresentando mutação somática de NF2. A taxa de controle de doença foi 69% e a taxa de sobrevida livre de progressão em 6 meses de 50% (83% nos tumores de grau I e 33% naqueles de graus II/III).
Comentário:
Estes resultados promissores colocam o inibidor de FAK GSK2256098 como potencial tratamento no futuro para os pacientes com meningiomas recorrentes de graus I-III.
O inibidor de IDH1 e IDH2 vorasidenibe foi avaliado no tratamento de 22 pacientes com gliomas não contrastantes (baixo grau) nesse estudo. A taxa de reposta foi 18,2%, e 72,7% dos pacientes apresentaram doença estável. A duração mediana do tratamento foi 25,8 meses, e a sobrevida livre de progressão mediana foi 31,4 meses.
Comentário:
Estes resultados são encorajadores e estudos adicionais são altamente justificados.
Estudo de fase II avaliando o papel da radioterapia em baixa dose após o tratamento quimioterápico em pacientes com linfoma primário do sistema nervoso central. Com um seguimento mediano de 55 meses, houve benefício em sobrevida livre de progressão com o uso de radioterapia combinada a quimioterapia em comparação a quimioterapia isolada (HR=0,51; IC de 95%: 0,27-,095; p = 0,015). As taxas de eventos adversos foram semelhantes entre os grupos, assim como as taxas de neurotoxicidade.
Comentário:
Este estudo, apesar de fase II randomizado, coloca a radioterapia em baixa dose em pacientes com linfoma primário do sistema nervoso central, após o tratamento quimioterápico baseado em metotrexato, como uma opção a ser considerada.
Tumores Gastrintestinais
Estudo de fase III apresentado na sessão plenária com 307 pacientes randomizados a pembrolizumabe (n = 153) ou quimioterapia (n = 154) no tratamento de primeira linha do câncer colorretal metastático com instabilidade de microssatélite. Com um seguimento mediano de 32,4 meses, o uso de pembrolizumabe reduziu em 40% o risco de progressão de doença ou morte em comparação a quimioterapia (HR=0,60; IC de 95%: 0,45-0,80; p = 0,0002). A taxa de resposta também foi superior com pembrolizumabe (43,8% versus 33,1%). A toxicidade de graus ≥ 3 foi menor com pembrolizumabe (22% versus 66%) Os dados de sobrevida global ainda são imaturos.
Comentário:
Baseado neste estudo, o pembrolizumabe se torna padrão no tratamento de primeira linha do câncer colorretal metastático com instabilidade de microssatélite.
Pacientes com câncer colorretal metastático HER-2 positivo previamente tratados com duas ou mais linhas receberam trastuzumabe deruxtecano nesse estudo. Os pacientes foram alocados em três coortes, de acordo com o espectro de positividade para HER-2: coorte A incluindo aqueles com IHQ 3+ ou IHQ 2+ e hibridização in situ positiva (n = 53), coorte B compreendendo aqueles com IHQ 2+ e hibridização in situ negativa (n = 7), e coorte C com pacientes apresentando IHQ 1+ (n = 18). O beneficio do tratamento foi confinado aos pacientes com expressão de HER-2 IHQ 3+, com taxa de resposta de 45,3% e com sobrevida livre de progressão mediana de 6,9 meses na coorte A. A eficácia da droga parece ser independente da exposição prévia a outro agente anti-HER-2. Quanto à segurança, a taxa de eventos adversos de graus ≥ 3 foi 60,4%. Apesar da presença de sinais de doença pulmonar intersticial ser um critério de exclusão do estudo, 6,4% dos pacientes desenvolveram a doença após o início do tratamento com trastuzumabe deruxtecano, incluindo 2 eventos fatais.
Atualização do estudo BEACON CRC, avaliando o uso de quimioterapia combinada a cetuximabe (braço controle) ou cetuximabe combinado com encorafenibe (inibidor de BRAF) +/- binimetinibe (inibidor de MEK) no tratamento do câncer colorretal metastático com mutação de BRAF V600E após progressão a uma ou duas linhas de terapia. A sobrevida global mediana foi idêntica entre os braços triplo e duplo (ambas 9,3 meses), e superiores em comparação ao braço controle (mediana 5,9 meses; HR=0,61; IC de 95%: 0,48-0,77). Não houve diferença na sobrevida livre de progressão mediana entre os braços duplo e triplo (4,3 e 4,5 meses, respectivamente). A taxa de resposta foi de 27% com o tratamento triplo, 20% com o tratamento duplo, e 2% para a quimioterapia.
Comentário:
A combinação do encorafenibe e cetuximabe é o tratamento padrão na segunda ou terceira linha do câncer colorretal metastático com mutação BRAF V600E.
Estudo prospetivo, randomizado, de fase II, multicêntrico, em pacientes com idade ≥ 70 anos portadores de câncer colorretal RAS–BRAF selvagens e sem tratamento prévio. Os pacientes foram randomizados para receber FOLFOX e panitumumabe (braço A) ou 5-fluorouracil e leucovorin (5-FU/LV) com panitumumabe (braço B) por até 12 ciclos, seguidos de manutenção com panitumumabe. A taxa de resposta e a sobrevida livre de progressão mediana foram semelhantes entre os braços FOLFOX e 5-FU associados a panitumumabe (65% versus 57% e 9,6 meses versus 9,1 meses, respectivamente).
Comentário:
Os resultados com 5-FU/LV e panitumumabe foram robustos, tornando esta combinação uma opção para esta população. Quando o estudo PANDA é analisado em perspectiva com outros estudos avaliando uma população semelhante, a sobrevida livre de progressão mediana foi 3,5 meses com 5-FU e 5,8 meses com capecitabina e oxaliplatina no estudo FOCUS2, que avaliou pacientes considerados não candidatos a tratamento quimioterápico em doses padrões, enquanto o mesmo desfecho foi de 5,1 meses com o uso de capecitabina isolada e 9,1 meses com capecitabina e bevacizumabe no estudo AVEX, que também avaliou pacientes com idade ≥ 70 anos. Todavia as taxas de resposta de ambos os estudos foram inferiores à taxa de resposta de 5-FU/LV e panitumumabe no estudo PANDA.
O estudo abordou duas variáveis: o uso de radioterapia de curta duração com altas doses sem quimioterapia concomitante, e o uso de tratamento neoadjuvante total (TNT). Pacientes com adenocarcinoma retal não metastático com características de alto risco na ressonância magnética (T4a ou T4b, invasão vascular extramural, N2, invasão da fáscia mesorretal, aumento dos linfonodos pélvicos laterais) foram randomizados entre braço padrão (n = 450) com quimiorradioterapia à base de capecitabina (25-28 frações x 2,0-1,8 Gy) seguida de excisão total mesorretal (TME) e tratamento adjuvante opcional (oito ciclos de CAPOX ou doze ciclos de FOLFOX4, à escolha do investigador) ou o braço experimental (n = 462), que consistiu de radioterapia (5 frações x 5 Gy) seguida por seis ciclos de CAPOX ou nove ciclos de FOLFOX4 (TNT) e TME na sequência. As taxas de sobrevida livre de doença e sobrevida livre de metástases em 3 anos favoreceram o TNT (HR=0,69; p = 0,034, e HR=0,64; p = 0,017, respectivamente), assim a taxa de resposta patológica completa (28% versus 14%).
Comentário:
Os resultados deste estudo tornam radioterapia de curta duração seguida de TNT como opção para pacientes com adenocarcinoma retal não metastático de alto risco.
O tratamento peri-operatório do câncer de pâncreas ressecável foi avaliado nesse estudo randomizado de fase II através de dois diferentes regimes quimioterápicos: mFOLFIRINOX ou gencitabina e nab-paclitaxel administrados por 12 semanas antes e após a ressecção cirúrgica. A taxa de ressecção foi 85% em ambos braços. A taxa de resposta patológica completa ou maior foi 25% com mFOLFIRINOX e 42% com gencitabina e nab-paclitaxel, e a taxa de sobrevida aos 2 anos foi 41,6% e 48,8% nos mesmos braços, respectivamente. Importante ressaltar que menos de 50% dos pacientes foram capazes de completar todo o tratamento quimioterápico pós-operatório planejado.
Comentário:
Este estudo sugere que o tratamento neoadjuvante com gencitabina e nab-paclitaxel pode ser uma opção ao mFOLFIRINOX e deve ser explorado em estudos maiores no tratamento neoadjuvante do câncer de pâncreas ressecável.
Estudo randomizado de fase II que avaliou o tratamento neoadjuvante com dois regimes quimioterápicos (FOLFIRINOX ou gencitabina e capecitabina combinadas) ou quimiorradioterapia (utilizando capecitabina como agente radiossensibilizante na dose de 830 mg/m2 duas vezes ao dia de segunda a sexta-feira) versus cirurgia imediata em pacientes com câncer de pâncreas borderline ressecável. O objetivo primário foi taxa de ressecção (R0 + R1) e, essencialmente, não houve diferença significativa entre os grupos (62% e 55% para tratamento neoadjuvante e cirurgia imediata, respectivamente; p = 0,668). Todavia, o objetivo secundário de sobrevida em 1 ano foi superior entre os pacientes que receberam alguma forma de tratamento neoadjuvante em comparação à cirurgia imediata, 77% versus 42% (HR=0,28; p < 0,001). Entre os diferentes braços, a taxa de sobrevida em 1 ano foi numericamente maior no grupo que recebeu FOLFIRINOX (84%), seguido de gencitabina e capecitabina (79%), seguidos de quimiorradioterapia (64%). Todavia estas diferenças não foram estatisticamente significativas dado o número limitado de pacientes recrutados em cada braço.
Comentário:
Este estudo reforça o papel do tratamento pré-operatorio em pacientes com câncer de pâncreas borderline ressecável
O inibidor de tirosina quinase donafenibe foi comparado a sorafenibe no tratamento de primeira linha de pacientes com carcinoma hepatocelular avançado nesse estudo. O tratamento com donafenibe foi associado a benefício em sobrevida global (HR=0,839; IC de 95%: 0,706-0,996; p = 0,0446), porém não houve diferença na sobrevida livre de progressão, taxa de resposta e taxa de controle de doença. A taxa de adversos de graus ≥ 3 com donafenibe foi inferior a sorafenibe.
Comentário:
Este estudo confirma a inferioridade do sorafenibe como terapia de primeira linha no carcinoma hepatocelular. O papel de donafenibe como tratamento de primeira linha é incerto, devido os benefícios demonstrados tanto pela combinação de atezolizumabe e bevacizumabe no estudo IMbrave 150, quanto de levantinibe no estudo REFLECT, ambos também superiores a sorafenibe.
A adição de trastuzumabe ao regime trimodal no tratamento do adenocarcinoma de esôfago ou junção gastroesofágica (T1N1-2, T2-3N0) com hiperexpressão de HER-2 foi avaliado nesse estudo. Como resultado, não houve diferença na sobrevida livre de doença entre os braços com ou sem o uso de trastuzumabe (38,9 versus 38,5 meses, respectivamente; HR=0,97; IC de 95%: 0,69-1,36).
Comentário:
A adição de trastuzumabe ao regime trimodal no tratamento do adenocarcinoma de esôfago ou junção gastroesofágica (T1N1-2, T2-3N0) com hiperexpressão de HER-2 não é recomendada fora de estudo clínico.
O estudo de fase II PETRARCA randomizou pacientes com adenocarcinoma esofagogástrico HER-2 positivo não metastático (cT2-T4 ou N+ independente do T) entre FLOT ou FLOT com adição de trastuzumabe e pertuzumabe. O estudo foi encerrado prematuramente após a divulgação da ausência de benefício em sobrevida global no estudo JACOB. Dentre os 81 pacientes randomizados, a taxa de resposta patológica completa foi superior no braço que recebeu terapia combinada anti-HER-2 (12% versus 35%; p = 0,02). As análises de sobrevida livre de doença e sobrevida global ainda são imaturas.
Comentário:
O estudo JACOB avaliou a incorporação de pertuzumabe à quimioterapia e trastuzumabe no tratamento de pacientes com doença metastática HER-2 positiva. As medianas de sobrevida global foram 17,5 meses para quimioterapia com trastuzumabe e pertuzumabe e 14,2 meses para quimioterapia com trastuzumabe, porém p = 0,057. Em conjunto, estes estudos resgatam o interesse quanto ao papel da combinação de trastuzumabe e pertuzumabe à quimioterapia em pacientes com adenocarcinoma esofagogástrico HER-2 positivo. Os resultados mais maduros do estudo PETRARCA são aguardados com expectativa e existem outros estudos em planejamento explorando a combinação.
Tumores de Cabeça e Pescoço
Estudo comparando pesquisa de linfonodo sentinela (seguida de dissecção linfonodal se necessário) à dissecção linfonodal cervical eletiva de rotina em pacientes com câncer de cavidade oral e orofaringe. Não houve diferença na taxa de sobrevida livre de recorrência cervical aos 2 anos entre os grupos, bem como na sobrevida doença-específica e na sobrevida global.
Comentário:
As análises de morbidade relacionada ao tratamento favoreceram o uso da pesquisa de linfonodo sentinela em detrimento à dissecção linfonodal.
Estudo avaliando a desintensificação do tratamento radioterápico adjuvante após cirurgia no câncer de orofaringe p16+. Alguns pontos merecem destaque dentre os resultados: cerca de um terço dos pacientes necessitou de um tratamento trimodal com a administração de quimiorradioterapia adjuvante e cerca de 10% dos pacientes apresentaram bom prognóstico com uso de cirurgia isolada. Dentre aqueles pacientes que apresentam risco intermediário de recorrência, o uso de radioterapia adjuvante em menor dose (50 Gy em 25 frações) sugere ser tão eficaz quando o emprego da radioterapia padrão (60 Gy em 30 frações) na redução do risco de recorrência, com taxas de sobrevida livre de progressão aos 2 anos de aproximadamente 95% em ambos os braços.
Comentário:
O papel de radioterapia em dose baixa na adjuvância precisa ser corroborado em estudos de fase III.
Dois regimes de administração de cisplatina em combinação a radioterapia foram avaliados nesse estudo em pacientes com carcinoma escamoso de cabeça e pescoço previamente submetidos a ressecção cirúrgica e apresentando características patológicas de alto risco para recorrência. Não houve diferença na sobrevida global, bem como na sobrevida livre de recorrência com o uso de cisplatina na dose de 40 mg/m2 semanal quando comparado a 100 mg/m2 a cada 3 semanas, com melhor perfil de toxicidade no primeiro esquema.
Comentário:
A dose de cisplatina 40 mg/m2 dada em combinação com a radioterapia pode ser considerada novo tratamento padrão, certamente no cenário adjuvante, e possivelmente no cenário de quimiorradioterapia definitiva de imediato.
Resultados iniciais do uso de tipifarnibe no tratamento de tumores de cabeça e pescoço com mutação de HRAS demonstrando taxa de resposta de 42,9% com duração mediana de 14,7 meses e sobrevida livre de progressão mediana de 5,9 meses.
Melanoma
Dois estudos avaliando o tratamento neoadjuvante do melanoma com a combinação de ipilimumabe e nivolumabe. O estudo PRADO confirma a eficácia da combinação demonstrando taxa de resposta patológica de 71% (50% respostas completas, 10% respostas quase completas e 10% respostas parciais). Enquanto o estudo OpACIN-neo demonstra que 96,9% dos pacientes com resposta patológica apresentam-se vivos e livres de recorrência após 2 anos do tratamento.
Comentário:
Embora a neoadjuvância com imunoterapia não seja ainda padrão, a tendência atual é esta. Temos favorecido esta estratégia em nosso serviço pois demonstra alta eficácia e baixa toxicidade (graus 3 e 4 da ordem de 20%).
Dois estudos avaliando a estratégia de tratamento combinado com ipilimumabe e um anti-PD-1 em pacientes com melanoma metastático que apresentaram progressão a um anti-PD-1 isolado. A taxa de resposta com o tratamento combinado foi 27% e 32% nos dois estudos, enquanto o uso de ipilimumabe como monoterapia foi associado a 13% de respostas.
Comentário:
Estes estudos sugerem que em pacientes com progressão a anti-PD-1 isolado, a melhor estratégia é manter o anti-PD-1 e adicionar ipilimumabe.
CheckMate 067: Long-term outcomes in patients with mucosal melanoma.
Atualização dos dados do estudo CheckMate 067 com análise dos desfechos dos pacientes com melanoma de mucosa metastático. A taxa de resposta com a combinação de ipilimumabe e nivolumabe foi 43% nesses pacientes, com taxa de sobrevida aos 5 anos de 36%.
Comentário:
Este estudo sugere que ipilimumabe mais nivolumabe é a melhor opção para melanoma de mucosa. Anti-PD-1 isolado teve desfecho claramente pior.
Estudo chinês avaliando a combinação do anti-PD-1 toripalimabe com axitinibe no tratamento de pacientes com melanoma de mucosa metastático. Destaca-se a atividade da combinação, com taxa de resposta de 48,5% e duração mediana de resposta de 13,7 meses. A sobrevida global mediana da população foi 20,7 meses, com 44,8% dos pacientes vivos aos 2 anos.
Comentário:
Este estudo sugere que a combinação de um anti-angiogênico com anti-PD-1 é bastante ativo em melanoma de mucosa.
Publicado em 23/06/2020
Por Dr. Daniel Vargas P. de Almeida com comentários dos editores do MOC
Apoio:
Veja também:
