Continúe su lectura
Terapia oral aprobada para tumores raros de huesos y articulaciones en EUA
Los tumores tenosinoviales de células gigantes son un grupo de neoplasias poco frecuente. Como tal, los registros epidemiológicos son escasos en esta patología, sin embargo, los datos disponibles muestran que la edad media de presentación varía entre 30-50 años (entre los diferentes subtipos), y hay una mayor participación en la sexta población femenina. El uso de la cirugía se considera el tratamiento estándar en la mayoría de los casos, sin embargo, el procedimiento a veces se asocia con una limitación funcional significativa y morbilidad cuando se emplea en la enfermedad localmente avanzada y recurrente. El 2 de agosto, el Food and Drug Administration (FDA) anunció la aprobación de pexidartinib, un inhibidor oral de la tirosina quinasa dirigido a CSF1R, KIT y FLT3, en el tratamiento de tumores tenosinoviales de células gigantes sintomáticos no candidatos a tratamento quirúrgico, o com expectativa de morbilidad exacerbada con el abordaje quirúrgico.
La evaluación de este fármaco se realizó a través del estudio ENLIVEN de fase III que aleatorizó a 120 pacientes para recibir tratamiento con pexidartinib o placebo. Alrededor de un tercio de los pacientes en ambos brazos de tratamiento ya se habían sometido a ≥ 2 procedimientos quirúrgicos para la enfermedad. Después de un análisis preliminar realizado por el comité de monitoreo de datos de seguridad, la inclusión de pacientes en el estudio finalizó antes de lo previsto inicialmente debido a la aparición de disfunción hepática grave como un evento adverso en dos pacientes. Debido a estos eventos, el FDA ha incluido un recuadro de advertencia que alerta (boxed warning) a los pacientes y profesionales de la salud sobre el riesgo potencialmente fatal de complicaciones hepáticas.
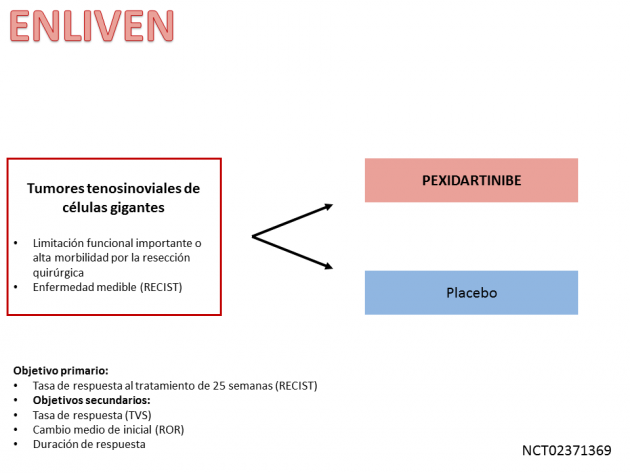
El estudio logró su resultado primario: tasa de respuesta después de 25 semanas de tratamiento. El grupo tratado con pexidartinib en este momento tenía una respuesta del 39% (respuesta completa del 15%), mientras que ningún paciente en el grupo placebo tuvo una respuesta. La tasa de respuesta global fue del 53%. Después de 6 meses de seguimiento, ningún paciente que logró una respuesta mostró progresión y, con una mediana de seguimiento de 22 meses, no se logró la mediana de la duración del beneficio.
Los eventos adversos de grado 3 y 4 ocurrieron en el 44% de los pacientes tratados con pexidartinib. Entre los eventos más comunes se encuentran: transaminasas hepáticas elevadas y fosfatasa alcalina, hipertensión y despigmentación del cabello.
Por el Dr. Daniel Vargas P. de Almeida
