Continúe su lectura
Cabozantinib esta aprobado para el tratamiento del cáncer de tiroides avanzado en los EUA
La FDA (Food and Drug Administration) aprobó el 17 de septiembre de 2021 el inhibidor de multicinasa cabozantinib para el tratamiento de pacientes con carcinoma de tiroides localmente avanzado o metastásico refractario al yodo o no candidatos a esta modalidad terapéutica después de la progresión a un inhibidor de VEGFR.
El tratamiento con cabozantinib en este contexto se evaluó en el estudio de fase III COSMIC-311 que aleatorizó a 258 pacientes a una proporción de 2:1 entre cabozantinib o placebo, cuyos datos actualizados se presentaron en la ESMO 2021. Entre la población incluida en el estudio, poco más más de la mitad de los pacientes tenían histología papilar, aproximadamente el 70% de los pacientes tenían metástasis pulmonares y aproximadamente una cuarta parte de los pacientes habían sido tratados previamente con 2 inhibidores de la tirosina quinasa VEGFR (sorafenib y lenvatinib).
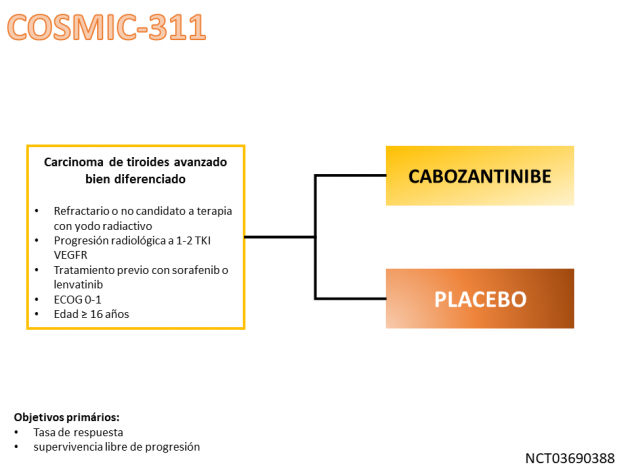
Con una mediana de seguimiento de 10,1 meses, el tratamiento con cabozantinib redujo el riesgo de progresión de la enfermedad o muerte en un 78% en comparación con placebo (HR=0,22; IC del 95%: 0,15-0, 32; p<0,0001), con medianas de 11,0 frente a 1,9 meses. En un análisis de subgrupos preespecificado, el beneficio en la supervivencia libre de progresión fue constante independientemente de la exposición previa a sorafenib (HR=0,13), lenvatinib (HR=0,28) o ambos (HR=0,27). La tasa de respuesta al cabozantinib fue del 11%. Las toxicidades más frecuentes del tratamiento con cabozantinib fueron diarrea, síndrome mano-pie, fatiga, hipertensión y estomatitis.
El Dr. William William, oncólogo y director médico de Oncología Clínica y Hematología del Centro Oncológico BP – La Beneficência Portuguesa de Sao Paulo, destaca que “esta es una nueva e importante opción de tratamiento para una situación clínica sin muchos otros medicamentos disponibles”.
Por el Dr. Daniel Vargas P. de Almeida
