Continúe su lectura
Un nuevo tratamiento dirigido a una mutación específica en diversos tipos de tumor es aprobado en los Estados Unidos
La agencia reguladora norteamericana Food and Drug Administration (FDA) divulgó el 26 de noviembre de 2018 la aprobación acelerada del inhibidor de TRK (tropomyosin receptor kinasa) larotrectinib para el tratamiento de pacientes con tumores metastásicos o irresecables que presentan fusión del gen NTRK (neurotrophic receptor tyrosine kinasa) y que no poseen una opción satisfactoria de tratamiento alternativo, o que presentaron progresión a terapia previa.
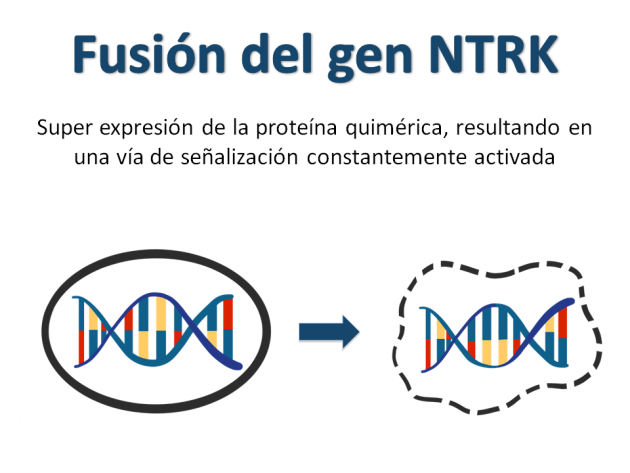
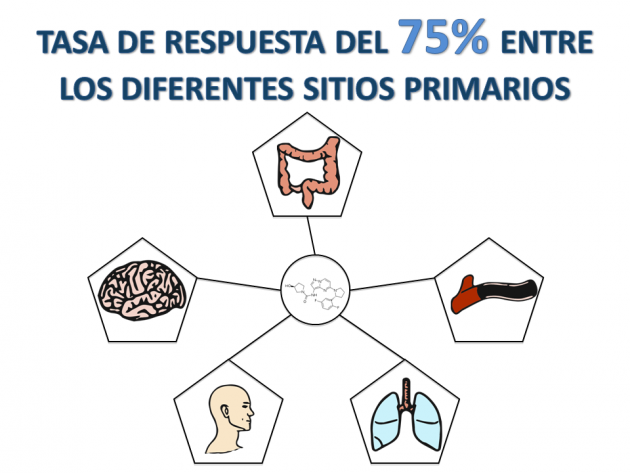
La eficacia del tratamiento con larotrectinib se evaluó en tres estudios clínicos combinados que incluyeron a 55 pacientes adultos y pediátricos portadores de diferentes tumores que presentaban la fusión del gen NTRK (y ausencia de mecanismos de resistencia conocidos) para los que la enfermedad se presentaba en estadio metastásico, o cuya resección podría resultar en elevada morbilidad. En la mayoría de los casos, la tasa de respuesta objetiva obtenida con el uso de larotrectinib fue de 75% en el estudio (carcinoma de glándula salival, fibrosarcoma infantil, cáncer de tiroides, colon, pulmón, melanoma, GIST, entre otros) el análisis del comité de revisión independiente, destacándose el 13% de pacientes con respuesta completa. En el momento de la divulgación de los datos, la duración de respuesta mediana aún no había sido alcanzada, sin embargo con 1 año de seguimiento, el 71% de los respondedores todavía mantenían el beneficio.
Los principales efectos adversos presentados con el tratamiento fueron fatiga, náusea, tos, alteración del hábito intestinal, mareo, vómitos y elevación de transaminasas, resaltando que el 93% de todos los efectos adversos fueron de grados 1-2 y que no hubo eventos adversos serios (grados 3-5) relacionados con el tratamiento.
En la nota divulgada para la prensa, la FDA resalta el carácter innovador de esa aprobación, que representa el segundo tratamiento oncológico aprobado basado en un marcador, independiente del sitio primario del tumor (así como el uso de pembrolizumab para pacientes con inestabilidad de microsatélite), caracterizando así como una “terapia agnóstica”.
“Aunque rara, la fusión del NTRK representa un verdadero” controlador gen “, irrespectivo del tipo de cáncer. Su bloqueo con larotrectinibe resulta en gran beneficio para los pacientes tratados. Por lo que todas las plataformas de genes deben incluir ahora el control de la fusión de NTRK “, dice el Dr. Antonio Carlos Buzaid, Director Médico General del Centro de Oncología Clínica de la BP – La Beneficencia Portuguesa de Sao Paulo y miembro del comité gestor del Centro de Oncología del Hospital Israelita Albert Einstein.
Por el Dr. Daniel Vargas P. de Almeida
