Continúe su lectura
Nueva opción de tratamiento para el cáncer de próstata no metastásico aprobado en EUA y Brasil
La agencia reguladora estadounidense Food and Drug Administration (FDA) aprobó el 13 de julio del 2018 el uso del agente anti-hormonal enzalutamida para el tratamiento de los pacientes con cáncer de próstata no metastásico resistentes a la castración. En el territorio nacional, la Agencia Nacional de Vigilancia Sanitaria (ANVISA) también amplió las indicaciones de tratamiento con enzalutamida el 30 de julio del 2018, adicionando la misma indicación de tratamiento recientemente aprobada en los Estados Unidos.
Estas aprobaciones se refieren a una nueva indicación de tratamiento para esta droga y se basan en los resultados del estudio de fase III PROSPER presentado en la ASCO-GU 2018 y recientemente publicado en el New England Journal of Medicine. Se trata de un estudio multicéntrico que aleatorizó a 1401 pacientes con cáncer de próstata no metastásico resistentes a la castración con criterios de alto riesgo (PSA ≥ 2 ng/ml con tiempo de duplicación ≤ 10 meses) para recibir tratamiento con enzalutamida o placebo, manteniendo la terapia de supresión androgénica. Después de una mediana de 18,4 meses de tratamiento con enzalutamida (11,1 meses con placebo), se evidenció reducción del 71% en el riesgo de metástasis o muerte con el uso de enzalutamida, con significativo aumento de la supervivencia libre de metástasis mediana de 14, 7 meses a 36,6 meses (HR 0,29, IC del 95% 0,24-0,35, p <0,001). Los datos de supervivencia global todavía son inmaduros en este análisis. En cuanto a los datos de seguridad, los eventos adversos de grado ≥ 3 fueron 31% con enzalutamida frente al 23% con placebo, siendo los más frecuentes astenia/fatiga, bochornos, hipertensión, vértigo, náuseas y caídas.
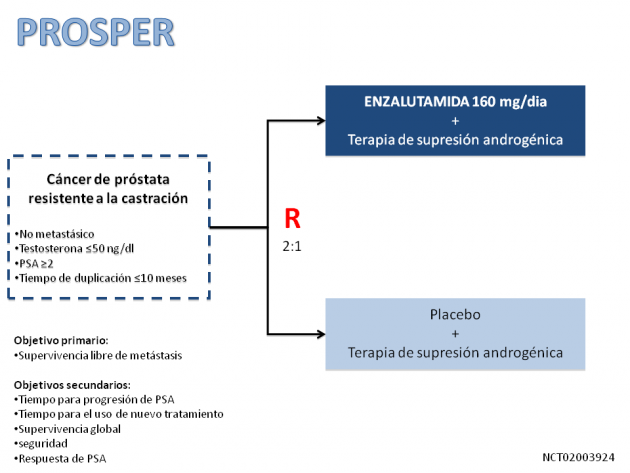
Según el Dr. Fabio Schutz, oncólogo de la BP – La Beneficencia portuguesa de Sao Paulo, “el tratamiento de pacientes con cáncer de próstata refractario a la castración (CRPC) y sin metástasis (nmCRPC) detectables por métodos de imagen convencionales permaneció hasta poco tiempo, como una necesidad no atendida, debido a la ausencia de terapias disponibles. Hasta entonces, el uso de enzalutamida y abiraterona estaba aprobado para pacientes con CRPC y presencia de enfermedad metastásica (mCRPC) visible. Ahora, con esta aprobación por ANVISA, los pacientes con nmCRPC pueden recibir tratamiento con enzalutamida, y prolongar así el tiempo hasta la aparición de la enfermedad metastásica. El estudio PROSPER demuestra y solidifica una cuestión conceptual extremadamente relevante, la importancia de la continua y profunda inhibición del receptor de andrógenos en el cáncer de próstata incluso en la vigencia de la testosterona sérica en niveles de castración, e incluso en presencia de enfermedad microscópica o de muy pequeño volumen (por ejemplo, nmCRPC). Sin embargo, el análisis de supervivencia global del estudio PROSPER todavía es inmaduro y será importante entender si el uso “muy precoz” de la enzalutamida, en el escenario nmCRPC, es capaz de aumentar la supervivencia global, ya que, por regla general, la mayoría de los pacientes con la nmCRPC hasta recientemente recibirían alguno de los nuevos agentes hormonales ya aprobados (enzalutamida y abiraterona) en el desarrollo de metástasis radiológicas. Esto será importante para discutir mejor la secuenciación del tratamiento, los costos financieros y los riesgos de eventos adversos relacionados con el uso muy temprano de esta droga en el escenario nmCRPC”.
Por el Dr. Daniel Vargas P. de Almeida
