Continúe su lectura
La evolución de los teranósticos en oncología: de la imagen al tratamiento personalizado
Este contenido fue doblado utilizando inteligencia artificial.
Para activar los subtítulos en español, haga clic en CC en la barra de progreso del video.
Desde que se comenzaron a explorar los primeros blancos terapéuticos en oncología, se han desarrollado diferentes estrategias para atacar las células tumorales de forma selectiva. Surgieron las pequeñas moléculas, los anticuerpos monoclonales, los conjugados anticuerpo-fármaco y, más recientemente, los radioligandos, que permiten transportar radiación de manera precisa hacia las células que expresan un blanco específico.
El uso de radiofármacos ya formaba parte de la práctica clínica en algunos contextos, como en el cáncer de tiroides tratado con yodo-131 y en los tumores neuroendocrinos con lutecio-177-dotatato. Sin embargo, cobró fuerza en la oncología con la llegada del lutecio-177-PSMA-617 (Pluvicto®, Novartis), aprobado para el cáncer de próstata metastásico resistente a la castración.
El concepto de teranóstico se basa en la utilización de un ligando específico (péptido, anticuerpo o pequeña molécula) capaz de unirse selectivamente a un blanco expresado en la célula tumoral. Asociado a dicho ligando, se incorpora un radionúclido emisor de radiación. En la aplicación diagnóstica se emplean radionúclidos emisores de positrones, como el galio-68, lo que permite visualizar la expresión del blanco mediante PET-CT. En la estrategia terapéutica, la radiación puede provenir de partículas beta, como en el caso del lutecio-177, que tienen un alcance tisular de algunos milímetros (0,5–2 mm), suficiente para alcanzar células vecinas; mientras que las partículas alfa, como el actinio-225, poseen un altísimo poder de ionización, con un alcance extremadamente corto, del orden de 50–100 micrómetros, produciendo un daño altamente localizado en el ADN, principalmente mediante roturas dobles.¹
Además del cáncer de próstata y los tumores neuroendocrinos, se están investigando nuevos blancos en tumores como mama, pulmón y páncreas, lo que indica que los teranósticos ganarán aún más espacio en el tratamiento oncológico.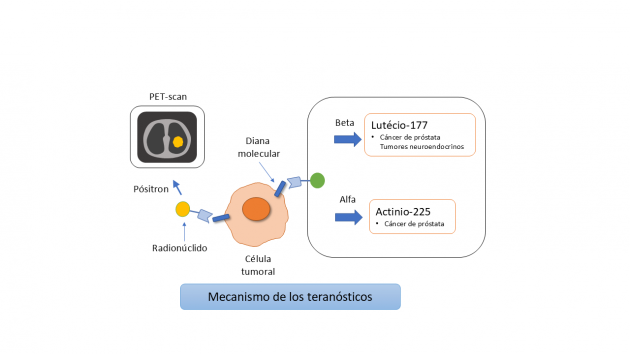
Cáncer de mama: objetivo HER-2
El desarrollo de radiofármacos en el cáncer de mama HER2 positivo avanzó inicialmente con la demostración de captación selectiva en las lesiones HER2 positivas mediante un nanocuerpo anti-HER2 marcado con tecnecio-99m (NCT04674722). Posteriormente, el estudio de fase I con el nanocuerpo terapéutico yodo-131-GMIB-anti-HER2-VHH1 (NCT04467515) mostró una buena captación tumoral en todos los pacientes y una respuesta parcial en uno de los tres tratados, sin toxicidad significativa. Aunque fue interrumpido por decisión estratégica, el estudio refuerza el potencial de los teranósticos en este escenario.²
Cáncer de páncreas: objetivo CA19-9
En el cáncer de páncreas, una de las estrategias implica el CA19-9, marcador ampliamente utilizado que puede elevarse incluso antes del diagnóstico definitivo de la enfermedad. La utilización del anticuerpo 5B1 (anti-CA19-9) marcado con circonio-89 demostró captación selectiva en las lesiones, validando el blanco en el contexto diagnóstico (NCT02687230). Para el tratamiento, el radiofármaco lutecio-177-5B1 fue evaluado en un estudio de fase I (NCT03118349) con 24 pacientes con adenocarcinoma pancreático u otros tumores CA19-9 positivos, evaluando seguridad, dosimetría y dosis máxima tolerada. El estudio se cerró en 2018 y los resultados aún no han sido publicados.
Cáncer de pulmón: objetivo DLL3
En el cáncer de pulmón de células pequeñas, el DLL3, presente en el 70–80% de los pacientes, ha sido explorado como blanco terapéutico, incluyendo el uso de tarlatamab, un anticuerpo biespecífico para enfermedad metastásica o recurrente tras progresión a al menos una línea previa de tratamiento. En la estrategia teranóstica, los anticuerpos anti-DLL3 marcados con circonio-89 demostraron captación selectiva, haciendo posible el DLL3 PET-CT.³ El radiofármaco terapéutico lutecio-177-SC16 fue evaluado en un estudio preclínico, logrando hasta un 70% de respuestas completas y una toxicidad hematológica transitoria y reversible, sin hepatotoxicidad significativa.⁴
Múltiples tumores: objetivo GRPR
Una estrategia emergente involucra al receptor GRPR (por sus siglas en inglés, Gastrin-Releasing Peptide Receptor), sobreexpresado en tumores de mama, próstata, pulmón y neuroendocrinos. El estudio en curso NeoRay (NCT03872778), presentado en la AACR 2024, evalúa el radiofármaco lutecio-177-NeoB (dirigido al GRPR) en aproximadamente 50 pacientes con tumores GRPR positivos. Los desenlaces incluyen tasa de control de la enfermedad, farmacocinética, biodistribución y dosimetría. Paralelamente, en el cáncer de próstata metastásico resistente a la castración PSMA negativo, se están llevando a cabo dos estudios de Clarity Pharmaceuticals. El estudio SABRE, con 53 pacientes, evaluó el cobre-64-SAR-BBN dirigido al GRPR, con una tasa de detección del 35% (datos divulgados por la empresa, aún no publicados en una revista científica). Por su parte, el estudio COMBAT, fase I/IIa, planea incluir hasta 38 pacientes, combinando cobre-64-SAR-BBN para la selección mediante PET-CT y cobre-67-SAR-BBN para el tratamiento, y sigue en fase de reclutamiento (NCT05633160).
Por lo tanto, los avances en las estrategias teranósticas han permitido una selección más precisa de los pacientes y la administración de tratamientos más dirigidos, con resultados clínicos prometedores. Aunque gran parte de las plataformas en desarrollo aún se encuentran en fases iniciales de investigación, los datos actualmente disponibles son consistentes y refuerzan el potencial de los teranósticos como un enfoque terapéutico innovador, con expectativas de una amplia expansión en la práctica oncológica en los próximos años.
Por el Dr. Caio Leite
Referencias:
- Burkett BJ, et al. A Review of Theranostics: Perspectives on Emerging Approaches and Clinical Advancements. Radiol Imaging Cancer. 2023; 5(4):e220157.
- Giugliano F, et al. Radioligand Therapy in Metastatic Breast Cancer: Harnessing Precision Oncology. Cancer Treat Rev. 2025; 136:102940.
- Tendler S, et al. Imaging with [89Zr]Zr-DFO-SC16.56 anti-DLL3 antibody in patients with high-grade neuroendocrine tumours of the lung and prostate: a phase 1/2, first-in-human trial. Lancet Oncol. 2024; 25(8):1015-1024.
- Tully KM, et al. Radioimmunotherapy Targeting Delta-like Ligand 3 in Small Cell Lung Cancer Exhibits Antitumor Efficacy with Low Toxicity. Clin Cancer Res. 2022; 28(7):1391-1401.
