Continúe su lectura
La combinación de nivolumab e ipilimumab está aprobada para el tratamiento del mesotelioma pleural en EUA
La Administración de Alimentos y Medicamentos (FDA) aprobó el 2 de octubre de 2020 la combinación de anticuerpos anti-PD-1 nivolumab y anti-CTLA4 ipilimumab para el tratamiento de primera línea de pacientes con mesotelioma pleural irresecable, basándose en los datos de eficacia de Estudio de fase III CheckMate743.
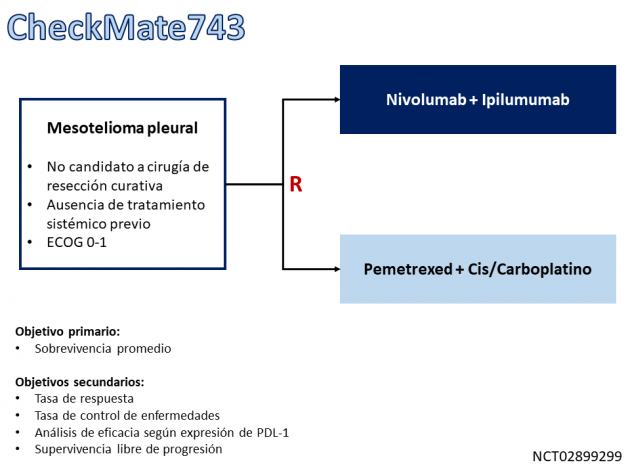
En este estudio, 606 pacientes con mesotelioma pleural irresecable fueron asignados al azar entre el tratamiento de primera línea con la combinación de nivolumab e ipilimumab administrados hasta por 2 años o 6 ciclos de quimioterapia con pemetrexed asociado con platino (cisplatino o carboplatino). Con una mediana de seguimiento de 29,7 meses, el estudio logró su objetivo principal, demostrando que la combinación de nivolumab e ipilimumab redujo el riesgo de muerte en un 26% en comparación con la quimioterapia (medianas de 18,1 frente a 14,1 meses; HR = 0,74; IC del 95%: 0,61-0,89; p = 0,002). La mediana de supervivencia libre de progresión fue de 6,8 frente a 7,2 meses (HR = 1,0; IC del 95%: 0,81-1,21) con inmunoterapia y platino doble, respectivamente. La tasa de respuesta fue similar entre los grupos (40% versus 43%), sin embargo, la duración media de la respuesta fue mayor en el brazo de inmunoterapia (11,0 versus 6,7 meses).
Entre los análisis de seguridad, los eventos adversos más comunes en los pacientes que recibieron nivolumab e ipilimumab fueron fatiga, dolor musculoesquelético, erupción cutánea, diarrea, disnea, náuseas, disminución del apetito, tos y picazón.
Las dosis recomendadas para esta indicación de tratamiento son nivolumab 360 mg por vía intravenosa (IV) cada 3 semanas e ipilimumab 1 mg / kg IV cada 6 semanas, ambos administrados durante un período máximo de 2 años o hasta que la enfermedad progrese o limite la toxicidad.
Cabe destacar que la revisión de los datos que motivaron la aprobación por parte de la FDA se realizó a través del Proyecto Orbis, una alianza colaborativa entre agencias reguladoras internacionales de diferentes países (Estados Unidos, Australia, Brasil, Canadá y Suiza) que tiene como objetivo agilizar el análisis para la aprobación de tratamientos oncológicos entre los países que integran la alianza.
Por el Dr. Daniel Vargas P. de Almeida
