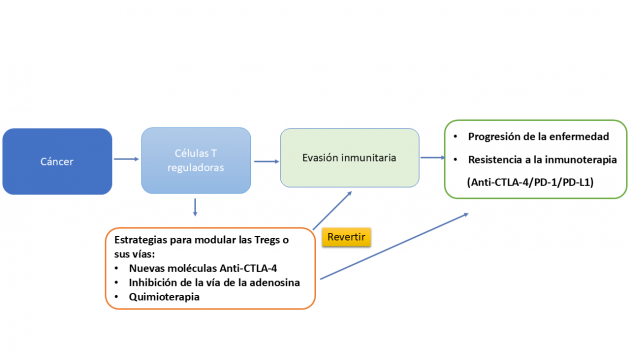
A continuación, se explorarán los principales aspectos del papel de las Tregs en el pronóstico, los mecanismos de resistencia y las estrategias terapéuticas dirigidas a su modulación.
Tregs y pronóstico del cáncer
El papel de las Tregs en las diversas fases de la carcinogénesis ha sido ampliamente estudiado debido a su naturaleza ambigua, simultáneamente protectora y permisiva.
Un metaanálisis reciente de 24 estudios en cáncer de pulmón de células no pequeñas (CPCNP) mostró que niveles más bajos de Tregs se correlacionan con mejor supervivencia global y libre de recurrencia. En cáncer de mama receptor hormonal positivo, se demostró que la heterogeneidad funcional de las Tregs va más allá de su densidad: una subpoblación que expresa la variante de splicing FOXP3 Exon 2 (FOXP3E2), con mayor capacidad inmunosupresora, se asoció con peor supervivencia. Estos hallazgos refuerzan que no solo la cantidad, sino el perfil molecular de las Tregs influye en el desenlace clínico.
El impacto pronóstico, sin embargo, varía según el tipo tumoral. En un metaanálisis de 17 estudios que incluyó a 3.811 pacientes con cáncer colorrectal, una alta densidad de Tregs FOXP3⁺ en el estroma y epitelio tumoral se correlacionó positivamente con la supervivencia global a 1, 3, 5 y 10 años. De manera similar, análisis histológicos de tumores resecados mostraron que la relación CD8/FOXP3 intratumoral es un marcador independiente de supervivencia global (HR=0,43; IC del 95%: 0,19-0,95), indicando que los tumores con predominio de linfocitos citotóxicos y escasez de Tregs presentan un mejor control inmune.
Tregs y resistencia a la inmunoterapia
Existen evidencias sólidas de que las Tregs participan en la resistencia a la inmunoterapia. En carcinoma renal de células claras metastásico, una mayor fracción de Tregs PD-1⁺ intratumorales se asoció con peores desenlaces con nivolumab: supervivencia libre de progresión de 3,19 versus 5,78 meses (p=0,021), supervivencia global de 18,1 versus 27,7 meses (p=0,013) y tasa de respuesta del 12,5% versus 31,3% (p=0,059), indicando ausencia de beneficio cuando predominan Tregs PD-1⁺.
En cáncer gástrico, el bloqueo de PD-1 con nivolumab puede expandir Tregs PD-1⁺ altamente proliferativas (Ki67⁺) en pacientes con hiperprogresión, además de aumentar la actividad supresora de estas células in vitro y en modelos murinos, sugiriendo un mecanismo importante de escape.
Un estudio traslacional reciente mostró que las Tregs infiltrantes en tumores de pulmón y piel exhibieron reprogramación transcripcional inmunosupresora tras el bloqueo de PD-1/PD-L1, con aumento de la expresión de CTLA-4, TIGIT, LAG-3 y CD39, correlacionándose con ausencia de respuesta clínica. De forma consistente, pacientes no respondedores con cáncer de pulmón y mesotelioma presentaron expansión de Tregs PD-1⁺ Ki-67⁺ en sangre periférica, evidenciando que el bloqueo de PD-1/PD-L1 puede inadvertidamente potenciar la actividad supresora de estas células, contribuyendo a la resistencia adaptativa a la inmunoterapia.
Tregs como objetivo terapéutico
La comprensión del papel de las Tregs ha estimulado el desarrollo de estrategias de modulación selectiva, con el objetivo de revertir la resistencia inmunológica y restaurar la actividad antitumoral.
El enfoque más antiguo, el uso de ciclofosfamida en dosis bajas (metronómica) en pacientes con tumores avanzados, demostró capacidad de inducir apoptosis de Tregs. En estudios iniciales, el tratamiento resultó en una disminución significativa de Tregs circulantes tras cuatro semanas, con mejora de la proliferación y citotoxicidad de células efectoras, aunque el efecto fue transitorio y heterogéneo entre pacientes. Ensayos posteriores combinaron el fármaco con vacunas tumorales y bloqueo de checkpoints, pero sin impacto consistente en la supervivencia global, reforzando que, aunque accesible y seguro, el efecto inmunomodulador de la ciclofosfamida sigue siendo limitado fuera de protocolos experimentales.
En los últimos años, el enfoque de inmunomodulación se ha orientado hacia intervenciones capaces de actuar directamente sobre el microambiente tumoral. Entre estas estrategias, el bloqueo de la vía de la adenosina (CD73/CD39/A2A) surge como uno de los enfoques más prometedores.
En el ensayo COAST (fase 2, n=189), realizado en pacientes con CPCNP estadio III, la combinación de durvalumab + oleclumab (anticuerpo anti-CD73) promovió una mejora significativa en la supervivencia libre de progresión (HR=0,59; IC del 95%: 0,37-0,93) y una mayor tasa de respuesta objetiva (35% versus 23,9%) en comparación con durvalumab solo, sin aumento de eventos adversos de grado ≥ 3.
Además de esta vía, estrategias avanzadas de modulación selectiva de Tregs cobraron relevancia en ESMO 2025, reforzando el interés en la depleción intratumoral controlada como un nuevo eje de la inmunoterapia. En este contexto, anticuerpos anti-CTLA-4 de nueva generación, como botensilimab y HBM4003, demostraron capacidad mejorada para reducir Tregs intratumorales y potenciar la activación de linfocitos efectores. La combinación botensilimab (anticuerpo anti-CTLA-4 Fc-optimizado) y balstilimab (anticuerpo anti-PD-1) se evaluó en un estudio multicéntrico de fase Ib que incluyó a 123 pacientes con cáncer colorrectal metastásico con microsatélites estables y sin metástasis hepáticas activas. La tasa de respuesta objetiva fue del 20%, con 42% de los pacientes vivos a los 24 meses y mediana de supervivencia global de 20,9 meses.
Estos avances consolidan un cambio de paradigma en la inmunoterapia oncológica: el futuro no depende solo de intensificar la activación de linfocitos efectoras, sino también de modular con precisión el control inmunológico impuesto por las Tregs, dirigiendo la respuesta inmune de manera selectiva, eficaz y segura hacia el microambiente tumoral.
Por el Dr. Caio Leite
Referencias
- The Nobel Prize in Physiology or Medicine 2025. 6 Oct 2025. Disponível em: https://www.nobelprize.org/prizes/medicine/2025/press-release/
- Leite CA, et al. J Immunother Cancer. 2020;8(1):e000129.
- Khambholja K, et al. Syst Rev. 2024;13(1):233.
- Fusco C, et al. Sci Adv. 2025;11(3):eadr7934.
- Hu G, et al. Oncotarget. 2017;8(43):75361-75371.
- Salama P, et al. J Clin Oncol. 2009;27(2):186-92.
- Denize T, et al. Clin Cancer Res. 2024;30(4):803-813.
- Kamada T, et al. Proc Natl Acad Sci U S A. 2019;116(20):9999-10008.
- van Gulijk M, et al. Sci Immunol. 2023;8(83):eabn6173.
- Ghiringhelli F, et al. Cancer Immunol Immunother. 2007;56(5):641-8.
- Aggarwal C, et al. JAMA Netw Open. 2025;8(7):e2518440.
- Schlechter BL, et al. Ann Oncol. 2025; 36(Suppl 7): S7–S8.