El ADN tumoral circulante (ctDNA) comenzó a explorarse en oncología como una alternativa a la biopsia tisular para la identificación de alteraciones genéticas en tumores avanzados, ayudando en la selección de terapias dirigidas y en la detección de resistencia adquirida. Con los avances tecnológicos y el aumento de la sensibilidad de las pruebas, su uso se ha expandido hacia la estimación del pronóstico, la detección de enfermedad mínima residual y, más recientemente, la orientación de decisiones terapéuticas, como en el contexto adyuvante, a ejemplo del estudio DYNAMIC en cáncer de colon resecado, donde el uso de ctDNA guió la indicación de quimioterapia.¹
Actualmente, el ctDNA también está siendo evaluado como herramienta para el monitoreo de la respuesta al tratamiento, complementando la evaluación clínica y radiológica. Este enfoque ha demostrado potencial para detectar respuesta temprana o falla terapéutica con mayor sensibilidad que los métodos convencionales de imagen. En este contexto, ya se encuentran disponibles pruebas como Signatera™ (Natera), Guardant Reveal™ (Guardant Health), Oncodetect™ (Exact Sciences) y FoundationOne® Tracker (Foundation Medicine/Roche), aunque todavía sin indicación formal en las guías clínicas internacionales.
En conjunto, estudios recientes, incluidos algunos presentados en la ASCO 2025, consolidan el papel del ctDNA como marcador en diferentes fases del recorrido oncológico, desde el seguimiento posterior al tratamiento curativo, hasta la evaluación de respuesta en el tratamiento neoadyuvante y en el escenario metastásico.
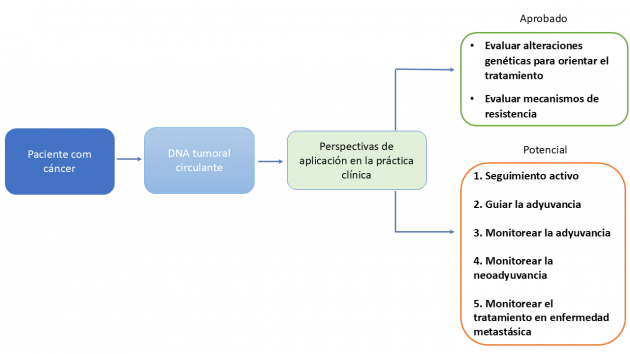
Seguimiento activo con ctDNA
Reforzando el potencial del ctDNA como herramienta de vigilancia en pacientes asintomáticos después del tratamiento curativo, un análisis retrospectivo reciente con seguimiento de 263 pacientes con diversos tipos de tumores y un acompañamiento mínimo de seis meses mostró que el ctDNA posoperatorio positivo se asoció con un riesgo significativamente mayor de recurrencia: 71,3 en cáncer de pulmón, 44,3 en colorrectal, 37,6 en mama y superior a 100 en gástrico. Además, la detección del ctDNA anticipó la recaída clínica hasta en 19,5 meses en el cáncer colorrectal, 14,4 en el pulmonar, 11,0 en el de mama y entre 5 y 9 meses en los tumores gástrico, hepático y ovárico.²
Uso del ctDNA en la decisión y monitoreo de la adyuvancia
En el cáncer de colon estadio II, la actualización del estudio DYNAMIC confirmó que la estrategia guiada por ctDNA redujo el uso de quimioterapia adyuvante (15% versus 28%) sin comprometer la supervivencia libre de recurrencia a 5 años (88% versus 87%) ni la supervivencia global (93,8% versus 93,3%).
En la adyuvancia del cáncer de mama RH positivo/HER-2 negativo, el estudio DARE, prospectivo y aleatorizado, presentado en la ASCO 2025, evaluó el monitoreo con ctDNA cada seis meses durante la terapia endocrina adyuvante. Entre las 432 pacientes con resultados persistentemente negativos, la tasa de supervivencia libre de recaída fue de 99% después de una mediana de 27,4 meses de seguimiento, reforzando el alto valor predictivo negativo de la estrategia. Las pacientes ctDNA-positivas fueron aleatorizadas para cambio de tratamiento con fulvestrant más palbociclib (brazo A) o mantenimiento de la terapia endocrina en curso (brazo B). La tasa de depuración del ctDNA fue superior en el brazo A (63% versus 22%), y la ausencia de disminución en los niveles del biomarcador se asoció con un mayor riesgo de recaída (HR=5,3; IC 95%: 1,1-53; p=0,04).³
Evaluación durante la neoadyuvancia/tratamiento perioperatorio con ctDNA
En la ASCO 2025, los datos actualizados del estudio CheckMate 816 reforzaron el papel del ctDNA como marcador pronóstico en el cáncer de pulmón de células no pequeñas (CPCNP) resecable. En un análisis exploratorio de pacientes con ctDNA positivo al inicio, la tasa de depuración preoperatoria fue superior en el grupo tratado con nivolumab y quimioterapia (56%) en comparación con la quimioterapia sola (35%). La disminución del ctDNA se asoció con una mejora en la supervivencia global (SG), con HR=0,38 (IC 95%: 0,15-1,00) en el brazo con inmunoterapia y HR=0,39 (IC 95%: 0,14-1,11) en el brazo control.⁴
En el contexto del cáncer urotelial, el estudio de fase III NIAGARA evaluó pacientes con cáncer de vejiga músculo-invasivo tratados con durvalumab asociado a quimioterapia neoadyuvante en comparación con quimioterapia sola, seguidos de cistectomía radical. La tasa de disminución del ctDNA entre el inicio del tratamiento y el período preoperatorio fue mayor en el brazo con durvalumab (41% versus 31%). Además, la supervivencia libre de enfermedad a 12 meses fue significativamente superior en el brazo experimental (82,3%) en comparación con el control (33,2%), reforzando el valor pronóstico de la persistencia de enfermedad residual.⁵
Monitoreo del ctDNA en el escenario metastásico
En el estudio de fase III SERENA-6, presentado en la ASCO 2025, se evaluó una estrategia de cambio precoz de tratamiento guiada por ctDNA en pacientes con cáncer de mama RH positivo/HER-2 negativo avanzado en uso de inhibidor de aromatasa (IA) asociado a inhibidor de CDK4/6. La detección de mutaciones en el gen ESR1 mediante ctDNA, antes de la progresión clínica, se utilizó como criterio para la aleatorización de 315 pacientes asintomáticas al cambio del IA por camizestrant, manteniendo el CDK4/6i. Esta intervención precoz resultó en una mejora significativa en la supervivencia libre de progresión (SLP): 16,0 meses versus 9,2 meses, con HR de 0,44 (IC 95%: 0,31-0,60; p<0,00001). Se trata de la primera evidencia de que el uso seriado del ctDNA puede identificar resistencia emergente y permitir una intervención terapéutica antes de la progresión radiológica.⁶
Estos estudios refuerzan el papel del ctDNA como biomarcador, con aplicaciones en diferentes fases del recorrido oncológico. Aunque todavía no incorporado formalmente a las guías clínicas, el ctDNA surge como una herramienta importante de la oncología de precisión, con potencial para anticipar decisiones clínicas, evitar tratamientos ineficaces y guiar conductas.
Por el Dr. Caio LeiteReferencias
- Tie J, et al. Circulating tumor DNA analysis guiding adjuvant therapy in stage II colon cancer: 5-year outcomes of the randomized DYNAMIC trial. Nat Med. 2025; 31(5):1509-1518.
- Hoang V, et al. Real-world utilization and performance of circulating tumor DNA monitoring to predict recurrence in solid tumors. JCO Oncol Adv. 2025; 2(4).
- Pusztai L, et al. Circulating tumor (ct)DNA monitoring of ER+/HER2– high-risk breast cancer during adjuvant endocrine therapy. J Clin Oncol. 2025; 43(16_suppl):1010.
- Forde PM, et al. Overall survival with neoadjuvant nivolumab (NIVO) + chemotherapy in patients with resectable NSCLC in CheckMate 816. J Clin Oncol. 2025;43(17_suppl):LBA8000.
- Powles T, et al. Circulating tumor DNA (ctDNA) in patients with muscle-invasive bladder cancer (MIBC) who received perioperative durvalumab (D) in NIAGARA. J Clin Oncol. 2025;43(16_suppl):4503.
- Turner NC, et al. Camizestrant + CDK4/6 inhibitor (CDK4/6i) for the treatment of emergent ESR1 mutations during first-line (1L) endocrine-based therapy (ET) and ahead of disease progression in patients (pts) with HR+/HER2– advanced breast cancer (ABC): Phase 3, double-blind ctDNA-guided SERENA-6 trial. J Clin Oncol. 2025;43(17_suppl): LBA4.
