Continúe su lectura
Carcinoma de piel de células escamosas recibe nueva aprobación de tratamiento en los Estados Unidos
El 28 de septiembre del 2018, la agencia reguladora estadounidense Food and Drug Administration (FDA) aprobó el anticuerpo monoclonal anti-PD-1 cemiplimab para el tratamiento de pacientes con carcinoma de piel de células escamosas metastásico o localmente avanzado no candidato a terapia curativa a través de cirugía o radioterapia.
La evaluación de eficacia que llevó a la aprobación de este nuevo anticuerpo se realizó mediante el análisis combinado del tratamiento de 108 pacientes incluidos en dos estudios, uno de ellos abierto y de fase I (Estudio 1423) y el otro randomizado de fase II (EMPOWER-CSCC -1 o Estudio 1540). Los datos previos de este análisis combinado ya se habían publicado en el periódico New England Journal of Medicine demostrando que el tratamiento con cemiplimab proporcionó una tasa de respuesta entre el 47-50% de los 86 pacientes en los diferentes estadios de la enfermedad. En la actualización de los resultados, utilizada para la aprobación del medicamento, considerando los 108 pacientes, la tasa de respuesta objetiva se mantuvo en el 47,2%, con una duración de respuesta superior a 6 meses en cerca del 60% de los pacientes. En cuanto a la seguridad del tratamiento, los efectos adversos más comunes fueron fatiga (29%), rash (25%) y diarrea (22%), bastante similar a los demás medicamentos de esta clase.
“La incorporación del cemiplimab para el tratamiento del carcinoma de piel de células escamosas ofrece a los pacientes no sólo una posibilidad de terapia efectiva para la enfermedad avanzada y metastásica, sino que también ofrecerá una perspectiva de reducción en la necesidad de abordajes quirúrgicos agresivos, y, a veces mutilantes”, como destaca el Dr. Rafael Schmerling, oncólogo de la BP – La Beneficencia Portuguesa de Sao Paulo.
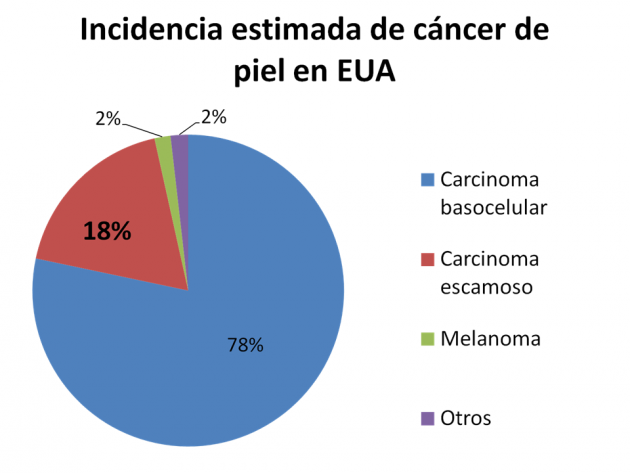
El carcinoma de piel de células escamosas es el segundo tumor de piel más común en los Estados Unidos, siendo responsable de cerca de 7.000 muertes cada año, siendo asociado la exposición a la radiación ultravioleta. Con esta aprobación, cemiplimab figura como la primera terapia aprobada en lo escenario norteamericanos exclusivamente para el tratamiento del carcinoma de piel de células escamosas, y es la sexta droga de la clase de los inhibidores de PD-1/PD-L1 a recibir la aprobación por la FDA.
Por el Dr. Daniel Vargas P. de Almeida
