Continúe su lectura
Terapia innovadora aprobada para el tratamiento del cáncer de mama triple negativo avanzado en los EUA
Usualmente asociado con un pronóstico menos favorable y con opciones terapéuticas limitadas en el escenario metastásico, el tratamiento del cáncer de mama triple negativo recibió la aprobación de una terapia innovadora por parte de la FDA (Food and Drug Administration) el 22 de abril. La agencia estadounidense otorgó la aprobación acelerada para el uso del anticuerpo anti-Trop2 conjugado sacituzumab govitecan-hziy para el tratamiento de pacientes con cáncer de mama avanzado triple negativo con exposición previa al menos a dos líneas de tratamiento sistémico. Trop2 es una glucoproteína transmembrana sobreexpresada en varios tumores epiteliales, y el tratamiento con sacituzumab govitecan-hziy da como resultado la internalización del componente citotóxico del fármaco, SN-38, un metabolito de irinotecán con una potente acción inhibidora de la topoisomerasa I.
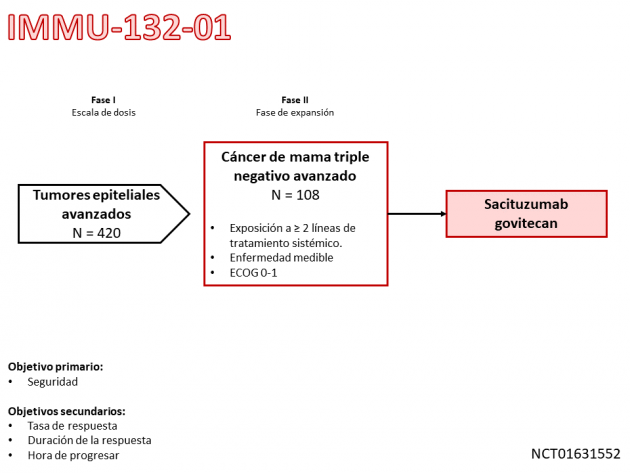
La aprobación se basa en los resultados del estudio clínico de fase II IMMU-132-01, que evaluó el tratamiento con sacituzumab govitecan-hziy en pacientes con tumores epiteliales de diferentes sitios primarios, entre los cuales habían 108 pacientes con cáncer de mama triple-negativo avanzado. Como resultado, el 33,3% de los pacientes tratados respondieron al tratamiento, con una mediana de duración del beneficio de 7,7 meses bajo revisión por el comité de revisión independiente. La mediana de supervivencia libre de progresión fue de 5,5 meses y la mediana de supervivencia global fue de 13,0 meses. En el análisis de seguridad, el 85% de los pacientes tuvieron eventos adversos de grado mayor o igual a 3. Los eventos adversos más frecuentes en cualquier grado fueron náuseas, diarrea, fatiga, neutropenia y anemia. Se destacan las tasas de eventos adversos hematológicos, con 42% y 11% de los pacientes que presentan neutropenia y anemia de grados ≥ 3, respectivamente, y neutropenia febril de cualquier grado ocurrió en el 9% de los pacientes.
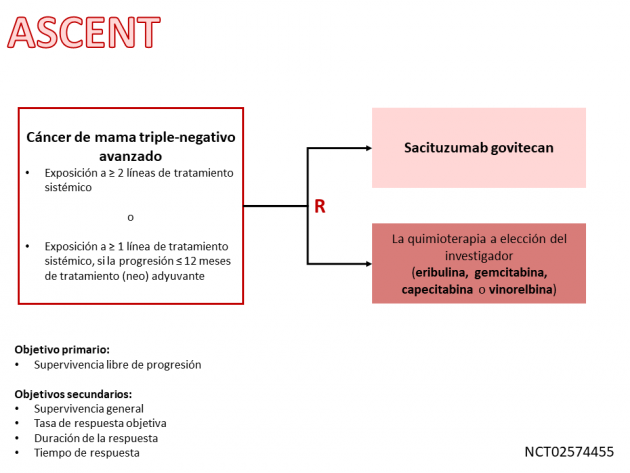
Por la aprobación acelerada por parte de la agencia de EUA, se desarrolló un estudio de fase III (ASCENT) que compara el sacituzumab govitecan-hziy con la elección del investigador en el tratamiento de pacientes con enfermedad triple negativa metastásica, cuyos resultados se utilizarán para validación de posible aprobación final. Según un “press release” de la compañía farmacéutica Immunomedics el 6 de abril, el estudio se detuvo tempranamente después de mostrar beneficios en diferentes objetivos finales bajo análisis por el comité independiente de monitoreo de datos. Los resultados deben informarse en un futuro próximo.
“Esta nueva molécula, una verdadera terapia diana, representa un gran avance en el tratamiento de pacientes con cáncer de mama triple negativo metastásico, y es probable que sea aprobada para otros tipos de cáncer de mama, así como otros tipos de cáncer”, dice el Dr. Buzaid , Director Médico General del Centro de Oncología BP – Hospital de la Beneficencia Portuguesa de São Paulo y Miembro del Comité de Gestión del Centro de Oncología del Hospital Israelita Albert Einstein.
Por el Dr. Daniel Vargas P. de Almeida
