Continúe su lectura
Nuevo anticuerpo aprobado para el tratamiento del cáncer de mama avanzado HER-2 positivo en EUA
La FDA (Food and Drug Administration) aprobó el 16 de diciembre de 2020, el anticuerpo monoclonal anti-HER-2 margetuximab para el tratamiento de pacientes con cáncer de mama avanzado HER-2 positivo previamente expuestas a dos o más regímenes de tratamiento antisistémico HER-2, uno que se administra necesariamente en el contexto de una enfermedad metastásica.
La aprobación se basa en los resultados del estudio de fase III SOPHIA, que aleatorizó a 536 pacientes con cáncer de mama metastásico HER-2 positivo previamente expuestas a tratamiento sistémico con terapias anti-HER-2 entre quimioterapia a elección del investigador (capecitabina, eribulina, gemcitabina o vinorelbina) combinado con margetuximab o trastuzumab. El brazo que recibió margetuximab mostró una reducción del 24% en el riesgo de progresión de la enfermedad o muerte en comparación con el brazo de trastuzumab (HR=0,76; IC del 95%: 0,59-0,98; p=0,033), un de los co-objetivos primarios del estudio, con medianas de 5,8 versus 4,9 meses, respectivamente.
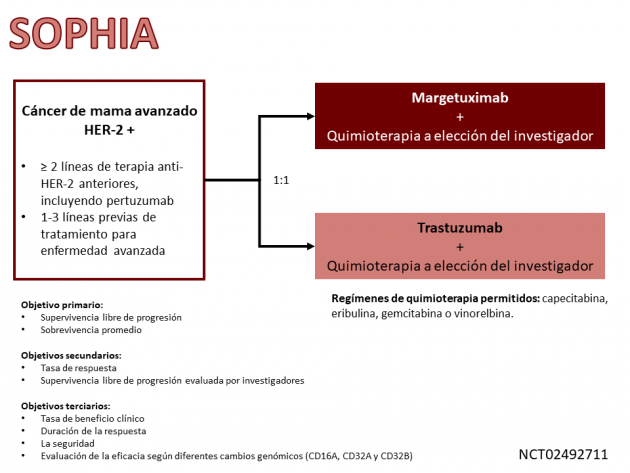
Los resultados preliminares de la supervivencia general, otro objetivo coprimario del estudio, se presentaron después del análisis intermedio de los datos en el congreso de San Antonio 2019, contemplando una mediana de seguimiento de 15,6 meses. La mediana de supervivencia global fue de 21,6 versus 19,8 meses para los brazos de margetuximab y trastuzumab, respectivamente (HR=0,89; IC del 95%: 0,69-1,13; p=0,326). La tasa de respuesta objetiva al régimen de margetuximab fue del 22%, mientras que el mismo resultado se observó en el 16% de los pacientes del grupo de trastuzumab, con una duración media del beneficio de 6,1 y 6,0 meses en los mismos grupos, respectivamente. La tasa de eventos adversos de grados mayores o iguales a 3 fue del 52% en el brazo de margetuximab, destacando la fatiga, náuseas, diarrea y vómitos como los eventos con mayor incidencia.
La dosis de tratamiento recomendada es de 15 mg/kg de margetuximab, por vía intravenosa, cada 3 semanas. Se debe prestar especial atención al riesgo de infusiones reactivas, evento adverso que presenta el 13% de la población estudiada, presentándose un 1,5% de ellas en grado 3.
Como destaca la Dra. Juliana Martins Pimenta, oncóloga clínica de la BP – La Beneficência Portuguesa de São Paulo, “recientemente se han logrado grandes avances en el tratamiento del cáncer de mama metastásico HER-2 positivo con la aprobación de medicamentos como trastuzumab deruxtecan y tucatinib y la aprobación actual de margetuximab por la FDA”.
Sin embargo, la Dra. Juliana señala: “en vista de resultados tan expresivos de eficacia en pacientes ampliamente politrados con el uso de los dos primeros medicamentos, trastuzumab deruxtecan con tasa de respuesta extremadamente alta (por encima del 60%) y supervivencia libre de progresión de 19 meses según datos actualizados en el congreso San Antonio 2020, y tucatinib con sus alentadores resultados para pacientes con metástasis en el sistema nervioso central, probablemente la opción de usar margetuximab será considerada en líneas posteriores, dados sus resultados más modestos de eficacia. Esperamos la aprobación en Brasil de trastuzumab deruxtecan y tucatinib por ANVISA próximamente”.
Por el Dr. Daniel Vargas P. de Almeida
