Continúe su lectura
Nuevo tratamiento para la macroglobulinemia de Waldenström aprobado en EUA
El 31 de agosto de 2021, la FDA (Food and Drug Administration) aprobó el inhibidor de BTK zanubrutinib para el tratamiento de pacientes adultos con macroglobulinemia de Waldenström, una de las formas de presentación del linfoma linfoplasmocítico de células B. Es la segunda molécula aprobada para pacientes con esta afección, además del ibrutinib asociado a rituximab.
El tratamiento con zanubrutinib se evaluó en el ensayo aleatorizado ASPEN, utilizando el fármaco en dos cohortes diferentes de pacientes. En la cohorte 1, los individuos portadores de la mutación MYD88 de tipo L265P se asignaron al azar a una proporción de 1:1 entre zanubrutinib o ibrutinib. En la cohorte 2, zanubrutinib de un solo brazo, se incluyeron pacientes sin mutación MYD88, así como aquellos con estado de mutación desconocido, para recibir tratamiento con zanubrutinib.
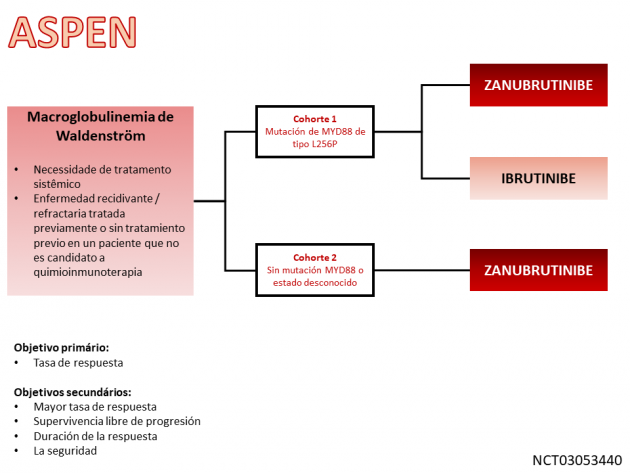
La aprobación del fármaco se basó en la tasa de respuesta (incluida la respuesta completa, la respuesta parcial muy buena y la respuesta parcial) evaluada de forma no comparativa en los brazos de la cohorte 1. La duración de la respuesta también fue un resultado adicional evaluado. Entre la población incluida, la mayoría de los pacientes presentaba una enfermedad en recaída o refractaria, y la mayoría de los pacientes habí estado expuesta previamente a agentes alquilantes y anticuerpos anti-CD20. En la cohorte 1, la tasa de respuesta para el brazo tratado con zanubrutinib fue del 77,5%, y el 94,4% de los encuestados mantuvo el beneficio durante al menos 12 meses. En el brazo de ibrutinib, los mismos resultados fueron 77,8% y 87,9%. En la cohorte 2, la tasa de respuesta fue del 50% con zanubrutinib. En la evaluación de seguridad, hubo menos fibrilación auricular con zanubrutinib (2%, todos los grados 1-2, versus 15% en general y 4% grado ≥ 3 con ibrutinib). La neutropenia fue el evento adverso más frecuente con zanubrutinib (29% en todos los grados y 20% en grado ≥ 3 y 13% en todos los grados y 8% en grado ≥ 3 con ibrutinib). La neumonía fue más común con ibrutinib que con zanubrutinib (respectivamente 12% versus 2% para todos los grados y 7% versus 1% para los grados ≥ 3). La neutropenia febril fue más común con zanubrutinib (4% y ningún caso con ibrutinib), pero ningún paciente murió, a diferencia de 2 muertes por sepsis con ibrutinib.
“En esta enfermedad, que es incurable y se caracteriza por recaídas, las opciones sin quimioterapia en casos recidivantes/refractarios son atractivas. Con esta aprobación, existe la posibilidad de utilizar otro inhibidor de la BTK, zanubrutinib, que a pesar de su eficacia similar a la del ibrutinib perfil de seguridad diferente, con una incidencia significativamente menor de fibrilación auricular, diarrea y neumonía, lo que contrarresta una tasa más alta de neutropenia en el grupo de zanubrutinib. El zanubritinib es el tercer fármaco en la clase de inhibidores de BTK que incluyen ibrutinib y acalabrutinib para trastornos linfoproliferativos. Inhibidores de BTK en desarrollo y en los próximos años tendremos varias opciones de fármacos de esta clase con alta actividad, beneficiándose en un mejor control de las enfermedades linfoproliferativas ”, destaca la Dra. Danielle Leão C. Farias, hematóloga e investigadora clínica de BP – La Beneficência Portuguesa de Sao Paulo.
Por el Dr. Daniel Vargas P. de Almeida
