Continúe su lectura
Nuevo tratamiento para el Cáncer Hepático aprobado en los Estados Unidos
La agencia reguladora norteamericana Food and Drug Administration (FDA) divulgó el 16 de agosto del 2018 la aprobación del inhibidor de tirosina quinasa lenvatinib para el tratamiento de primera línea del hepatocarcinoma irresecable.
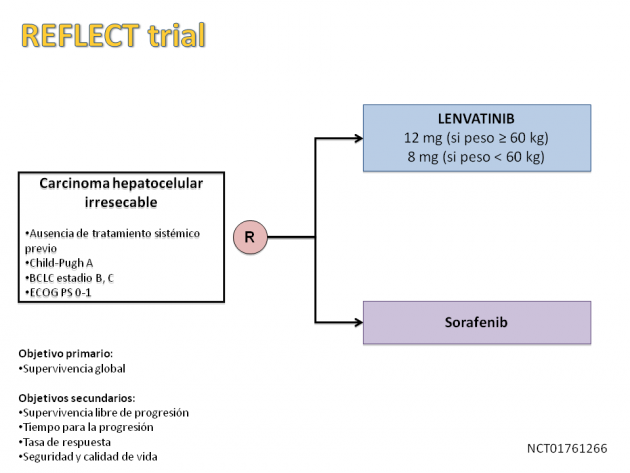
La aprobación del uso de lenvatinib en este escenario se basa en el estudio multicéntrico de fase III REFLECT. En este estudio, 954 pacientes con hepatocarcinoma irresecable sin ningún tratamiento sistémico previo fueron aleatorizados para recibir tratamiento con lenvatinib u otro inhibidor de tirosina quinasa, sorafenib. Con un seguimiento mediano de aproximadamente 27 meses, el tratamiento con lenvatinib alcanzó el criterio de no inferioridad para la supervivencia global en comparación con el tratamiento con sorafenib (sobrevida global mediana de 13,6 a 12,3 meses, HR = 0,92; del 95%: 0,79-1,06). La supervivencia libre de progresión mediana fue numéricamente superior en el tratamiento con lenvatinib (7,3 versus 3,6 meses, HR = 0,65, p <0,0001), así como la tasa de respuesta (18,8% frente a 6,5 %).
En cuanto a la seguridad del tratamiento, la tasa de efectos adversos de grado ≥3 fue similar entre los brazos de tratamiento (57% versus 49%), destacándose que el uso de lenvatinib se asoció a hipertensión, diarrea, reducción del apetito y, pérdida de peso.
La dosis recomendada del tratamiento es de 12 mg una vez al día para pacientes con un peso igual o superior a 60 kg o de 8 mg en el caso de pacientes con peso inferior a 60 kg.
Según el Dr. Ricardo Carvalho, oncólogo tratante del Departamento de Tumores Gastrointestinales de la BP – La Beneficencia Portuguesa de Sao Paulo, “de acuerdo con los datos del Global Burden of Disease Cancer Collaboration, el cáncer de hígado es la cuarta causa de muerte por cáncer en el mundo. Hasta entonces, sorafenib era la única droga aprobada en la primera línea de tratamiento en la enfermedad avanzada en los Estados Unidos. Recientemente, varios estudios fracasaron en demostrar la no inferioridad o superioridad de otras drogas en comparación con el sorafenib. El estudio REFLECT demostró que el lenvatinib es una excelente alternativa al sorafenib en la primera línea, produciendo una supervivencia global similar, con una mayor SLP y una mayor tasa de respuesta, sin embargo a expensas de una toxicidad ligeramente mayor. De esta forma, considero que la aprobación de lenvatinib en la primera línea es una excelente noticia para los pacientes en los Estados Unidos. El Dr. Ricardo Carvalho agrega: “este escenario podría cambiar en los próximos meses con la presentación del estudio CheckMate-459, el cual está evaluando la eficacia del nivolumab en la primera línea”.
Por el Dr. Daniel Vargas P. de Almeida
