Continúe su lectura
Nuevo anticuerpo anti-HER-2 aprobado para el tratamiento del cáncer gástrico avanzado en EUA
La FDA (Food and Drug Administration) aprobó el 15 de enero de 2021 el anticuerpo conjugado al fármaco trastuzumab deruxtecan para pacientes con adenocarcinoma gástrico o unión gastroesofágica (JGE) con expresión positiva de HER-2 previamente expuestos a tratamiento con HER-2 un régimen que contiene trastuzumab. “Esta es la primera terapia anti-HER-2 que demuestra eficacia y está aprobada por las agencias reguladoras para el tratamiento del adenocarcinoma gástrico esofágico con hiperexpresión de HER-2 desde la aprobación de trastuzumab hace más de 10 años”, dice el Dr. Lucas V. dos Santos, oncólogo clínico de la BP – La Beneficencia Portuguesa de São Paulo, en aprobación.
La eficacia del tratamiento aprobado se evaluó en el estudio de fase II DESTINY-Gastric01, que aleatorizó en una proporción de 2: 1 un total de 187 pacientes con adenocarcinoma gástrico o JGE metastásico con expresión de HER-2 previamente expuestos a dos o más regímenes de tratamiento sistémico, incluidos fluoropirimidina y trastuzumab, entre recibir trastuzumab deruxtecan o quimioterapia a elección del investigador (paclitaxel o irinotecan).
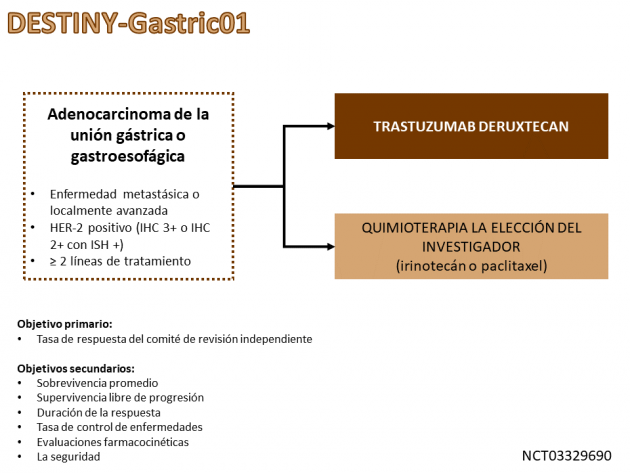
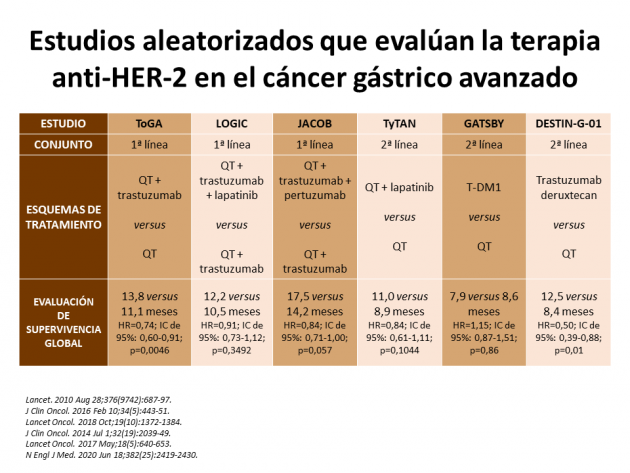
La tasa de respuesta evaluada por el comité independiente, el objetivo principal del estudio, fue del 51% versus 14% en los brazos de anticuerpos y quimioterapia, respectivamente (p<0,001). Los objetivos secundarios del estudio también favorecieron al brazo que recibió tratamiento con el anticuerpo conjugado al fármaco, entre los que destaca la supervivencia global (medianas de 12,5 versus 8,4 meses; HR=0,50; IC 95%: 0,39-0,88; p=0,01), supervivencia libre de progresión (5,6 versus 3,5 meses; HR=0,47; IC 95%: 0,31-0,71) y duración de respuesta (11,3 versus 3,9 meses).
También cabe señalar que, según un análisis preespecificado, la tasa de respuesta a trastuzumab deruxtecan estuvo directamente relacionada con la expresión de HER-2, siendo 58% en pacientes con puntuación 3+ por evaluación inmunohistoquímica, mientras que fue de 29% en aquellos con puntuación 2+ e hibridación in situ positiva. En las evaluaciones de seguridad, la tasa de reacciones adversas de grado ≥ 3 relacionadas con el tratamiento fue del 85,6% en el grupo de trastuzumab deruxtecan, destacándose como las reacciones adversas más frecuentes neutropenia, anemia, leucopenia, disminución del apetito y trombocitopenia. También es notable que el 10% de los pacientes del grupo de trastuzumab deruxtecan presentaban enfermedad pulmonar intersticial o neumonitis, un evento adverso relacionado con frecuencia con este fármaco en diferentes estudios, pero la mayoría de los casos fueron leves.
Por el Dr. Daniel Vargas P. de Almeida
