Continue sua leitura
Terapia-alvo é aprovada para tratamento do carcinoma urotelial avançado nos EUA
O carcinoma urotelial acomete cerca de 80.000 novos pacientes nos Estados Unidos anualmente, representando pouco menos de 5% dos novos casos de câncer na população americana. A despeito de apenas uma pequena parcela dos pacientes apresentarem doença metastática ao diagnóstico (4%), o prognóstico para os pacientes com esse estádio é frustrante, com taxa de sobrevida em 5 anos inferior a 5%. Esses dados destacam a importância da aprovação acelerada divulgada pela agência norte-americana FDA (Food and Drug Administration) no dia 12 de abril de 2019, regulamentando a utilização de erdafitinib, um inibidor oral do FGFR (receptor do fator de crescimento de fibroblastos), presente em aproximadamente 15% a 20% dos tumores uroteliais metastáticos.
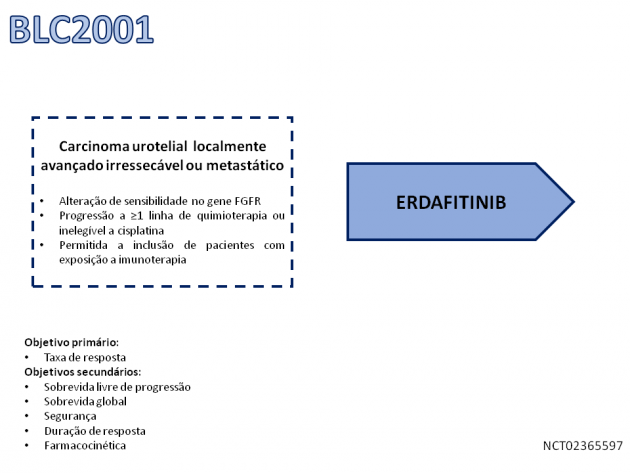
A aprovação é baseada nos dados do estudo fase II BLC2001, que avaliou o tratamento com erdafitinib em pacientes com carcinoma urotelial localmente avançado irressecáveis ou metastáticos com progressão a ≥1 linha de tratamento quimioterápico e portadores de mutações ativadoras do FGFR (mutação do FGFR3, ou fusões no FGFR2 ou FGFR3). Os dados atualizados apresentados no congresso da ASCO 2018 contemplaram o tratamento de 96 pacientes e demonstram uma taxa de resposta objetiva da ordem de 42%, com 3% de respostas completas. Dentre aqueles com algum grau de resposta, a duração mediana do benefício foi de 5,6 meses. Ressalta-se que 22% dos pacientes incluídos no estudo haviam recebido tratamento prévio com inibidor de checkpoint imunológico, sendo a taxa de resposta objetiva nesse subgrupo da ordem de 59%. Com um seguimento mediano de 11 meses, a sobrevida livre de progressão mediana foi de 5,5 meses, e a sobrevida global mediana de 13,8 meses.
Os eventos adversos relacionados ao tratamento com erdafitinib foram alterações na retina (promovendo alterações visuais em até 25% dos pacientes), além de hiperfosfatemia, estomatite, fadiga, elevação de creatinina, alterações do hábito intestinal, xerostomia, onicólise e alterações de enzimas hepáticas.
Dr. Fernando Maluf, oncologista e Diretor Médico Associado do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo, ressalta que “essa é a primeira medicação aprovada em câncer de bexiga que atua em um mecanismo de ação específico que está presente em até um quinto dos pacientes, envolvendo tanto a mutação quanto a fusão do fibroblastic growth fator. Ou seja, é a primeira droga aprovada para o tratamento desse tumor baseada na presença de um marcador específico”.
“Geralmente a presença de mutação ativadora do FGFR está relacionada a resistência aos inibidores de checkpoint. Paradoxalmente erdafitinib possui ação específica nessa alteração molecular, chegando como uma importante opção de tratamento nesses pacientes. A aprovação desse medicamento representa um enorme avanço no tratamento do câncer de bexiga, por ser uma droga bastante ativa, com efeitos adversos manejáveis, e indicada para um subtipo específico de pacientes selecionados através de um marcador”, conclui Dr. Fernando Maluf.
Por Dr. Daniel Vargas P. de Almeida
